总局发布2017年第5期国家医疗器械质量公告
更新时间:2017/3/29 12:57:05 浏览次数:2452国家食品药品监管总局于2017年3月28日发布国家医疗器械质量公告(2017年第5期,总第23期)。
为加强医疗器械质量监督管理,保障医疗器械产品使用安全有效,国家食品药品监督管理总局组织对手术衣、高频手术设备、总甲状腺素检测试剂等6个品种79批的产品进行了质量监督抽检。
现将抽检结果公告如下:
一、被抽检项目不符合标准规定的医疗器械产品,涉及2家医疗器械生产企业的2个品种2批(台)。
(一)手术衣1家企业1批产品。吉林弗朗医疗科技有限公司生产的1批一次性使用手术衣,抗渗水性(产品非关键区域)不符合标准规定。
(二)高频手术设备1家企业1台产品。广东百生医疗器械有限公司生产的1台高频电刀,外壳的封闭性不符合标准规定。
以上抽检不符合标准规定产品具体情况,见附件1。
二、被抽检项目为标识标签、说明书等项目不符合标准规定的医疗器械产品,涉及2家医疗器械生产企业的2个品种2台。
(一)输液泵/注射泵1家企业1台产品。长沙比扬医疗器械有限公司生产的1台输液泵,设备或设备部件的外部标记不符合标准规定。
(二)高频手术设备1家企业1台产品。广东百生医疗器械有限公司生产的1台高频电刀,设备或设备部件的外部标记不符合标准规定。
以上抽检不符合标准规定产品具体情况,见附件2。
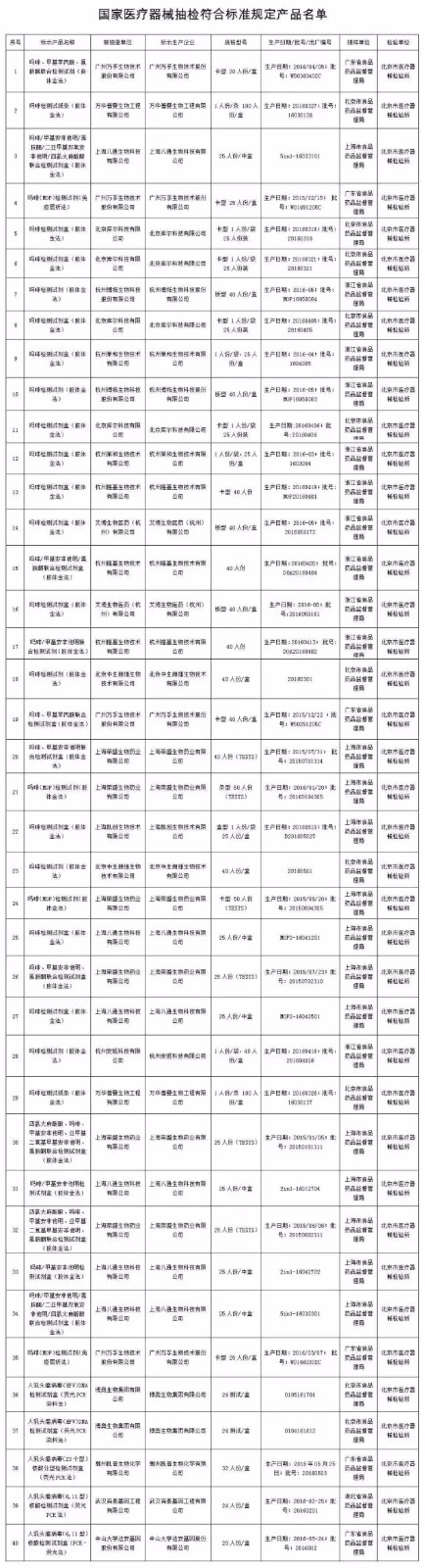
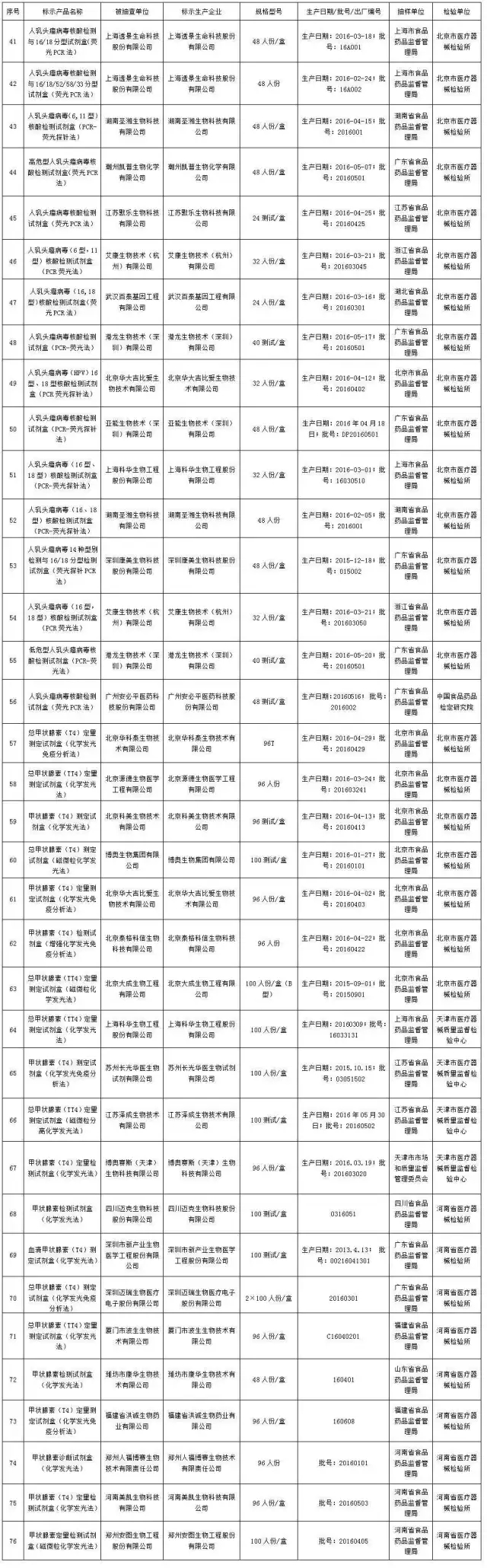
三、抽检项目全部符合标准规定的医疗器械产品涉及43家医疗器械生产企业的3个品种76批,见附件3。
四、对上述抽检中发现的不符合标准规定产品,国家食品药品监督管理总局已要求企业所在地食品药品监督管理部门按照《医疗器械监督管理条例》及《食品药品监管总局办公厅关于进一步加强医疗器械抽验工作的通知》(食药监办械监〔2016〕9号),对相关企业进行调查处理。
相关医疗器械生产企业应对不符合标准规定产品、不符合标准规定项目进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回并公开召回信息。企业所在地省级食品药品监督管理部门要对企业召回情况进行监督,未组织召回的应责令召回;如发现不符合标准规定医疗器械产品对人体造成伤害或者有证据证明可能危害人体健康的,应采取暂停生产、进口、经营、使用的紧急控制措施。相关省级食品药品监督管理部门要督促企业尽快查明原因,制定整改措施并按期整改到位,有关处置情况于2017年4月24日前向社会公布。

附件3
 扫描下载
扫描下载体外诊断头条APP
 扫描关注
扫描关注CAIVD官方微信
 扫描关注
扫描关注CAIVD官方视频号
 扫描关注
扫描关注CACLP官方微信
 扫描关注
扫描关注CACLP官方视频号
全国卫生产业企业管理协会实验医学分会
( 京ICP备15010734号-10 )



