医疗器械及IVD临床试验需选择备案机构(2019.1.1起)
更新时间:2019/1/3 14:39:45 浏览次数:3056 《医疗器械临床试验机构条件和备案管理办法》已经发布,自2018年1月1日起施行。申请医疗器械临床试验的机构自2018年1月1日起可登录食品药品监管总局网站(网址http://218.240.145.213:9000/CTMDS/apps /pub/public.jsp),点击“医疗器械临床试验机构备案管理信息系统”进行备案。
《医疗器械临床试验机构条件和备案管理办法》已经发布,自2018年1月1日起施行。申请医疗器械临床试验的机构自2018年1月1日起可登录食品药品监管总局网站(网址http://218.240.145.213:9000/CTMDS/apps /pub/public.jsp),点击“医疗器械临床试验机构备案管理信息系统”进行备案。
自2019年1月1日起,医疗器械(包括体外诊断试剂)临床试验申办者应当选取已经在备案系统备案的医疗器械临床试验机构,按照《医疗器械临床试验质量管理规范》(食品药品监管总局 国家卫生计生委令第25号)和《体外诊断试剂注册管理办法》(食品药品监管总局令第5号)的有关要求开展临床试验。
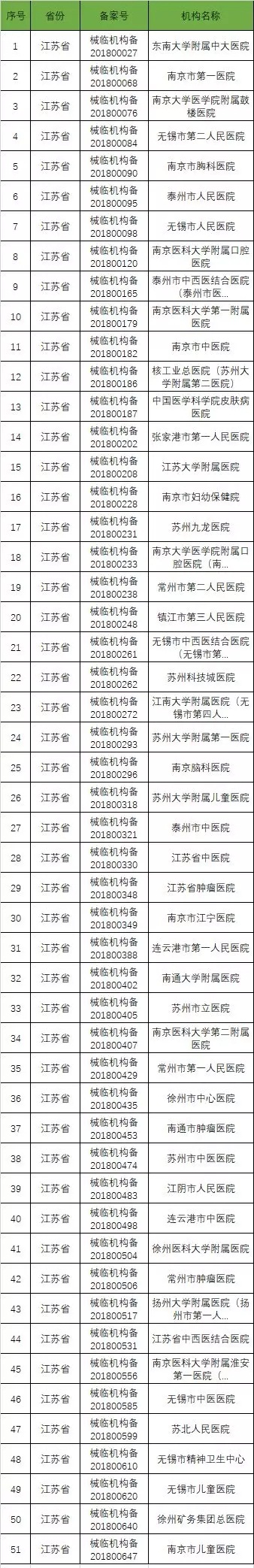
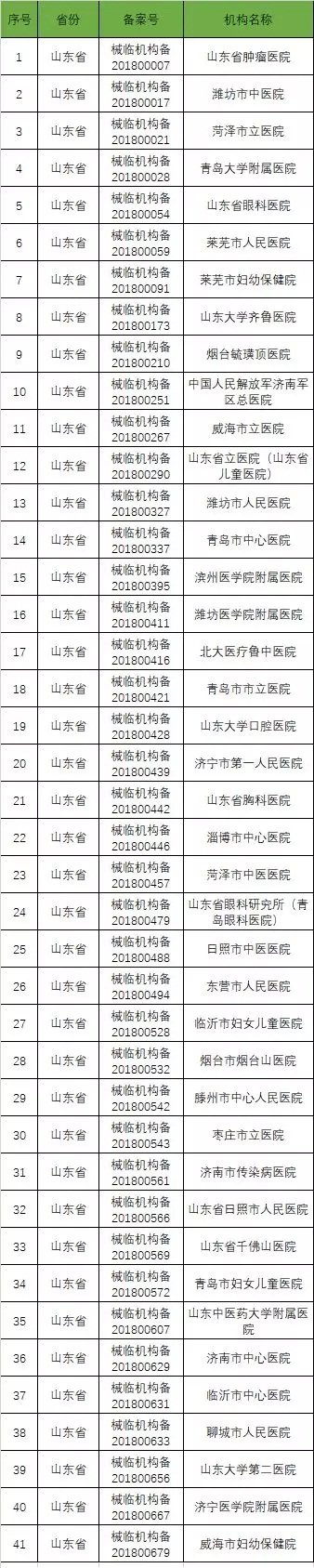
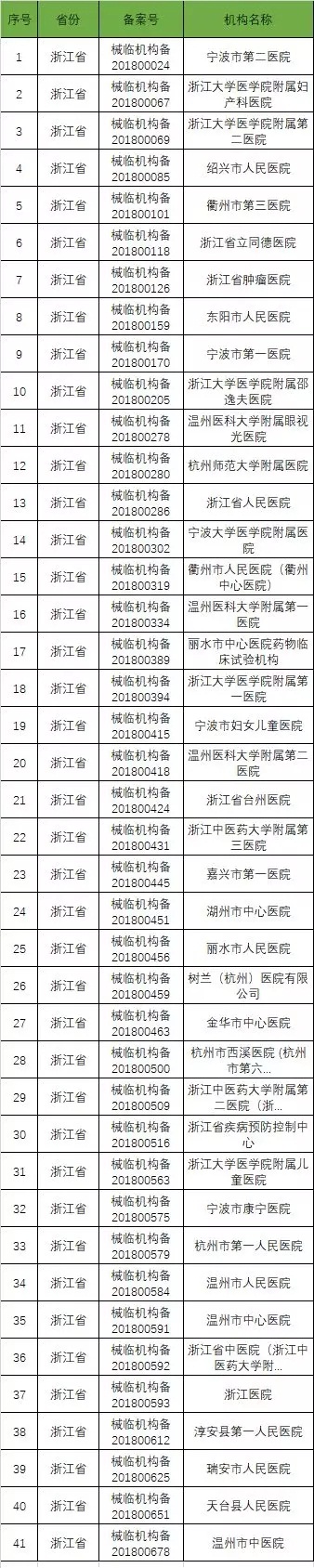
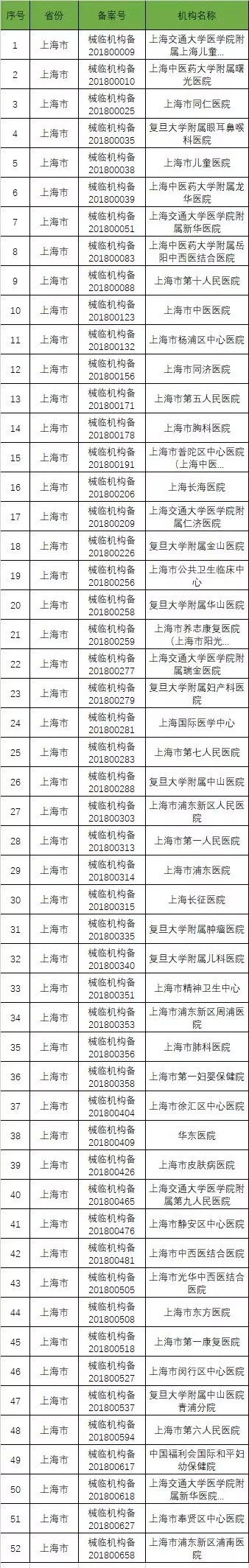
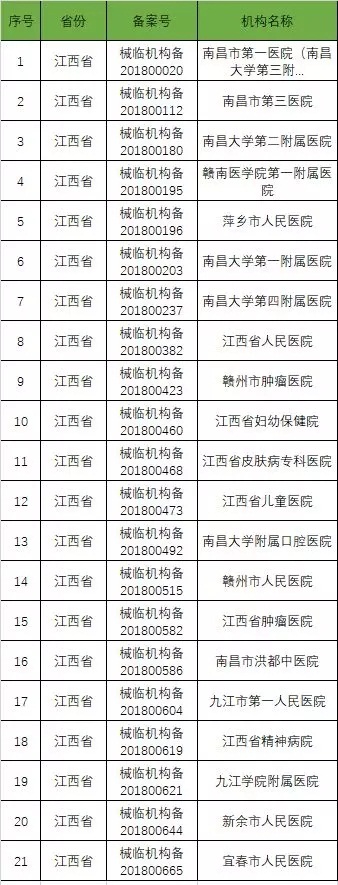
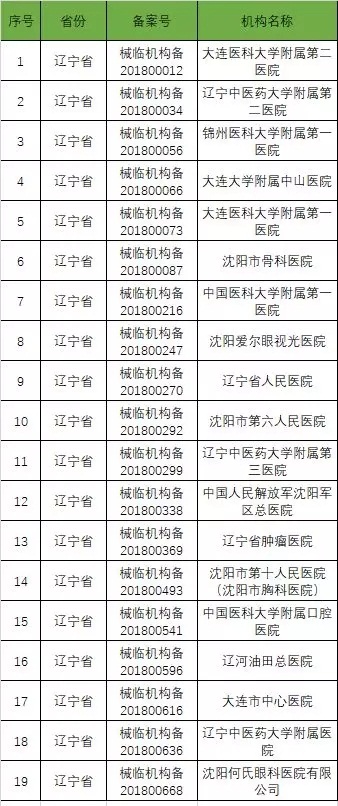
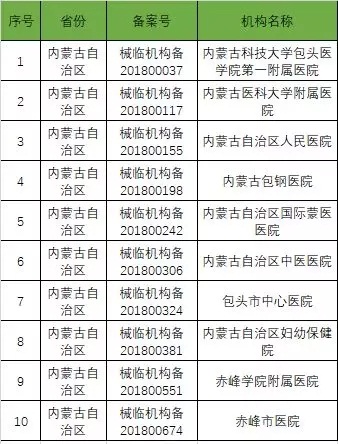
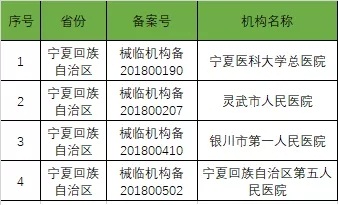
截至2019年1月2日,已在备案系统备案的医疗器械临床试验机构共680家。分别分布于29个省市区。
省份分布汇总表
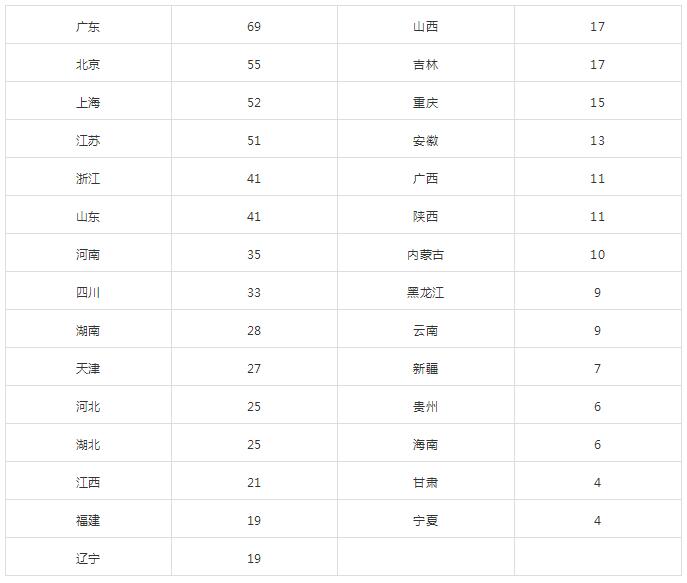
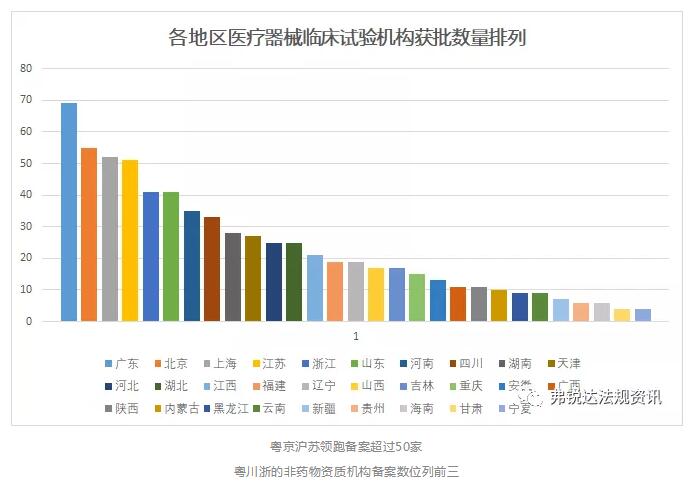
广东的总备案数和非药物资质机构备案数均为第一,2018年11月广东省药学会药物临床试验专业委员会医疗器械临床试验专业组,广东省医疗器械管理学会医疗器械临床试验专业委员会相继成立,融合协助服务项目。2018年截至11月底,广东省局办理新增医疗器械临床试验备案项目313个,其中,体外诊断试剂产品占项目总数近七成。
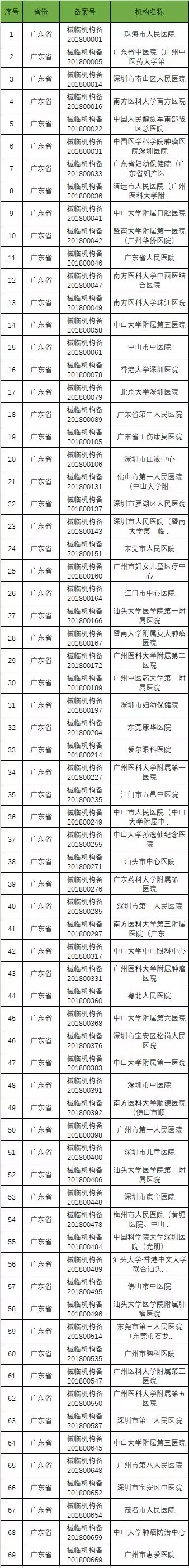
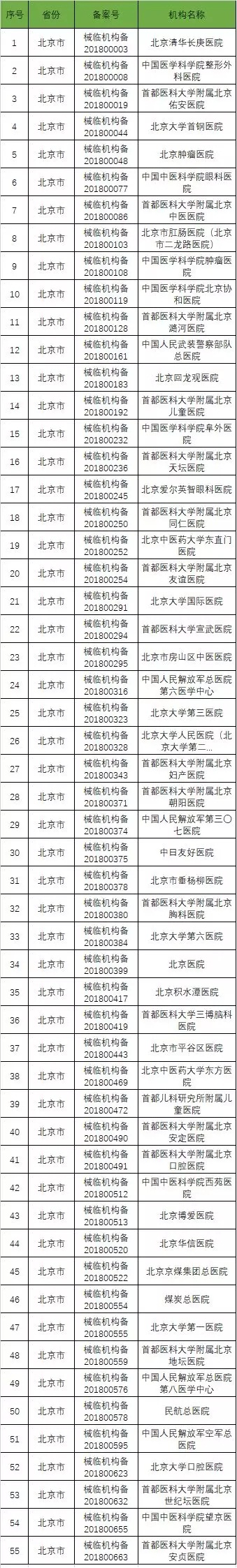
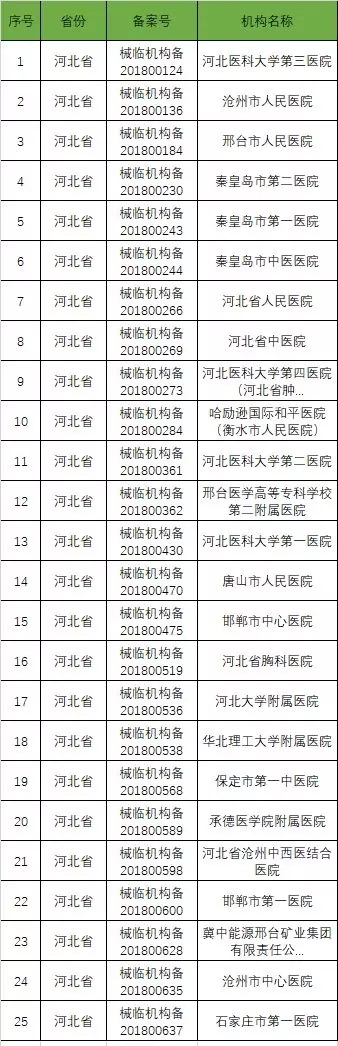
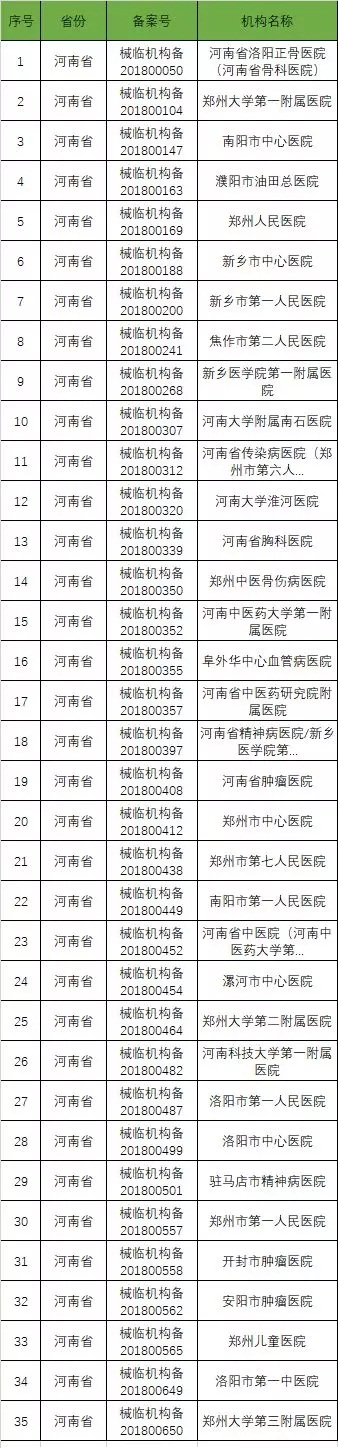
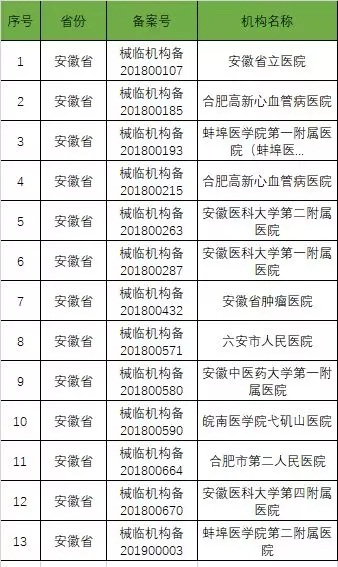
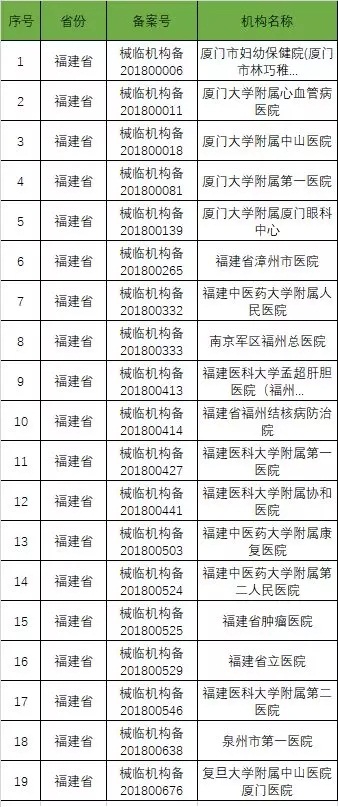
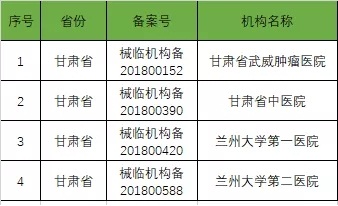
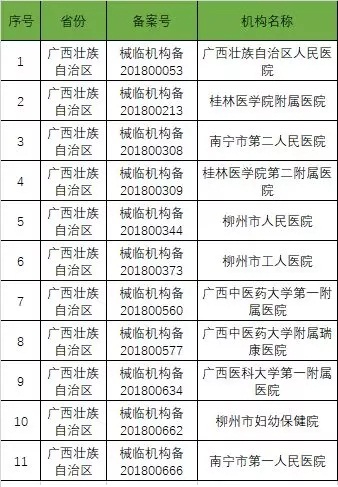
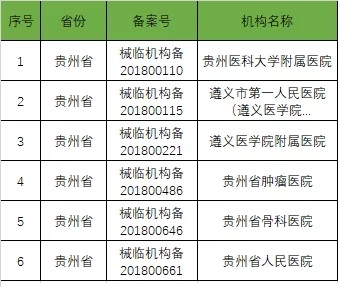
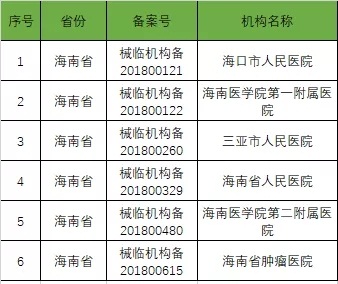
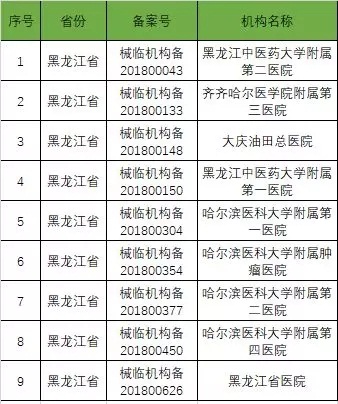
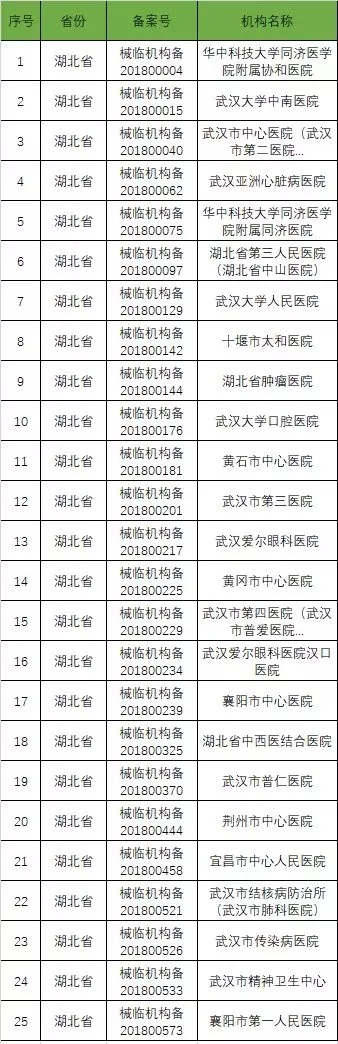
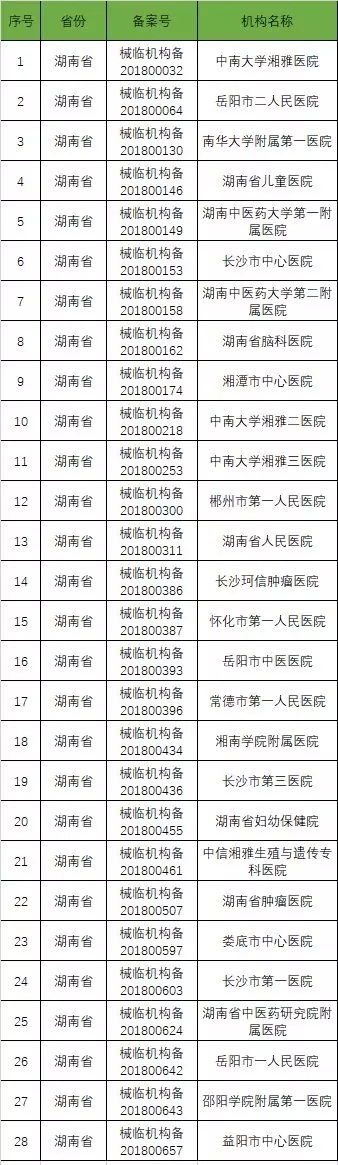
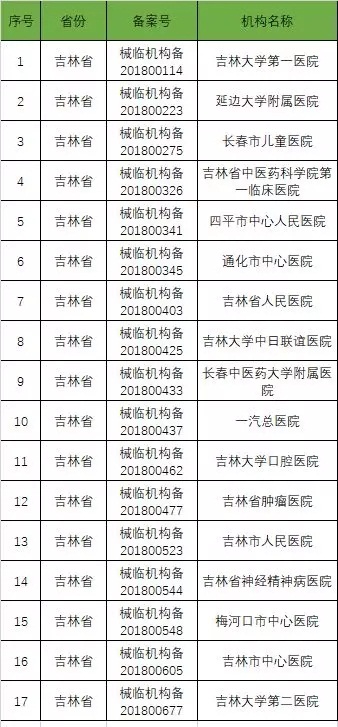
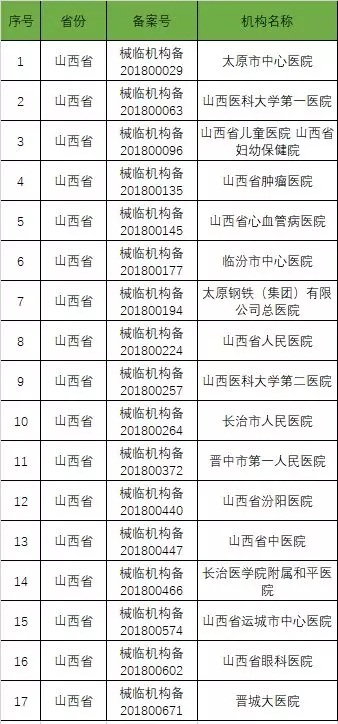
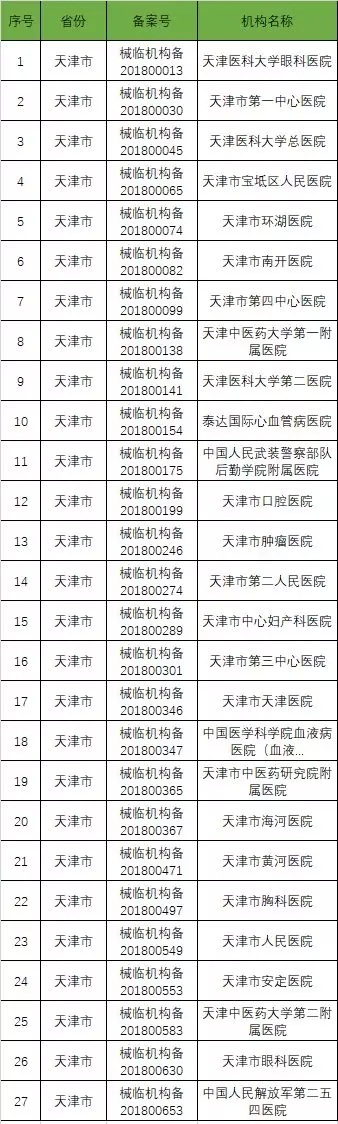
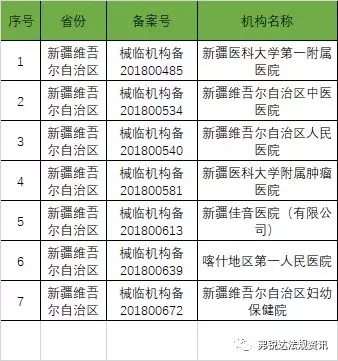
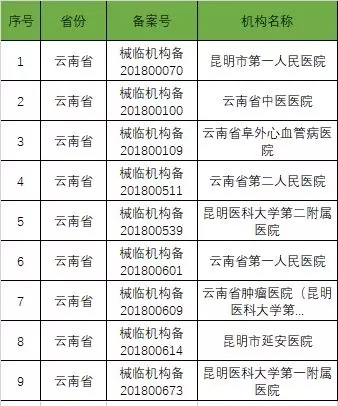
以下是680家临床试验机构:(按省份)



 扫描下载
扫描下载体外诊断头条APP
 扫描关注
扫描关注CAIVD官方微信
 扫描关注
扫描关注CAIVD官方视频号
 扫描关注
扫描关注CACLP官方微信
 扫描关注
扫描关注CACLP官方视频号
全国卫生产业企业管理协会实验医学分会
( 京ICP备15010734号-10 )



