
摘要
目的
分析特定疾病状态下脂蛋白(a)[Lp(a)]质量浓度和颗粒浓度检测结果的相关性。
方法
选取2018年9月—2019年8月复旦大学附属中山医院住院患者581例,其中男406例、女175例,年龄(63.59±14.52)岁,按照疾病类型分为冠心病组(133例)、肝癌组(76例)、糖尿病组(192例)和慢性肾脏病组(180例)。以同期体检健康者200名为健康对照组,其中男125名、女75名,年龄(61.84±5.50)岁。检测所有研究对象Lp(a)颗粒浓度和质量浓度。采用Spearman相关分析评价各组Lp(a)颗粒浓度和质量浓度的相关性;比较各组Lp(a)颗粒浓度和质量浓度阳性率差异;采用Passing-Bablok回归分析和Bland-Altman偏移分析评估各组通过颗粒浓度转换的质量浓度和直接检测得到的质量浓度的一致性。
结果
各组Lp(a)颗粒浓度和质量浓度相关性较好(r=0.948 7,P<0.05),其中冠心病组Lp(a)颗粒浓度和质量浓度相关性最高(r=0.976 3,P<0.05),肝癌组相关性最低(r=0.863 2,P<0.05)。糖尿病组、慢性肾脏病组Lp(a)颗粒浓度和质量浓度阳性率差异有统计学意义(P<0.05),健康对照组、肝癌组、冠心病组Lp(a)颗粒浓度和质量浓度阳性率差异无统计学意义(P>0.05)。各组通过Lp(a)颗粒浓度转换的质量浓度与直接检测得到的Lp(a)质量浓度的95%一致性界限均>1/2允许总误差。
结论
Lp(a)颗粒浓度和质量浓度有一定的相关性。特定疾病(冠心病、肝癌、糖尿病、慢性肾脏病)患者和健康对照者Lp(a)颗粒浓度和质量浓度阳性率差异不同。通过Lp(a)颗粒浓度转换的质量浓度与直接检测得到的Lp(a)质量浓度的差异超过了临床可接受范围,在临床实践中不建议将Lp(a)颗粒浓度和质量浓度进行转换。
关键词
脂蛋白(a);颗粒浓度;质量浓度;相关性
《中国心血管健康与疾病报告2021》指出:心血管疾病(cardiovascular disease,CVD)的发病率仍持续增高,2019 年,我国农村和城市人群CVD死亡例数分别占总死亡例数的46.74%和44.26%,每 5 例死亡者中就有2例死于CVD。脂蛋白(a)[lipoprotein(a),Lp(a)]是CVD的重要预示因子,其水平升高是发生CVD的独立危险因素。血清Lp(a)含量主要与遗传因素有关,基本不受性别、年龄、体重和大多数降胆固醇药物的影响。人类2岁时,LPA基因已完全表达,Lp(a)浓度通常在5岁时达到成人水平,但也可能逐渐增加直至成年。有研究发现,健康人群Lp(a)水平呈明显偏态分布。
1 材料和方法
1.1 研究对象
选取2018年9月—2019年8月复旦大学附属中山医院住院患者581例,其中男406例、女175例,年龄(63.59±14.52)岁。另选取同期复旦大学附属中山医院体检健康者200名(健康对照组),其中男125名、女75名,年龄(61.84±5.50)岁。经B超、心电图、临床各项检查和血糖、肝功能、肾功能等相关指标检测排除肝脏疾病、肾脏疾病、冠心病、肿瘤、糖尿病等病史和疾病。根据临床疾病诊断、实验室检验结果、影像学检查结果将581例住院患者分为冠心病组、肝癌组、糖尿病组、慢性肾脏病组。各疾病组患者均无其他3种疾病,各疾病组纳入者不重复入组。排除服用干扰 Lp(a)代谢药物和临床资料不完整患者。
1.1.1 冠心病组
共133例,其中男103例、女30例,年龄(62.48±11.10)岁。通过冠状动脉造影确认冠状动脉管腔狭窄>50%。排除肝癌等恶性肿瘤、糖尿病、慢性肾脏病、中度或重度瓣膜疾病、急性和慢性感染、严重手术相关并发症、预期寿命<1个月的严重合并症患者。
1.1.2 肝癌组
共76例,其中男58例、女18例,年龄(54.64±12.84)岁,符合《原发性肝癌诊疗指南(2022年版)》的诊断标准:具有典型肝癌影像学特征的肝脏占位性病变、血清甲胎蛋白水平异常等。排除冠心病、糖尿病、慢性肾脏病、胃肠道肿瘤和胆、胰及其他系统恶性肿瘤患者。
1.1.3 糖尿病组
共192例,其中男136例、女56例,年龄(63.54±12.05)岁,符合《中国2型糖尿病防治指南(2020年版)》的诊断标准:空腹血糖≥7.0 mmol/L或糖负荷2 h血糖≥11.1mmol/L,以糖化血红蛋白(glycated hemoglobin A1c,HbA1c)≥6.5%为补充诊断标准。排除冠心病、肝癌等恶性肿瘤、慢性肾脏病、妊娠糖尿病、甲状腺疾病、严重感染、急性疾病患者。
1.1.4 慢性肾脏病组
共180例,其中男109例、女71例,年龄(68.24±17.68)岁,符合文献诊断标准:肾脏结构或功能异常的肾损伤病程超过3个月,即估算肾小球滤过率(estimatedglomerular filtration rate,eGFR)降低(eGFR<60 mL/min·1.73 m2),如多囊肾、肾动脉狭窄、肾小球病变、肾脏血管疾病。根据2009年慢性肾脏疾病流行合作研究所(Chronic Kidney Disease Epidemiology Collaboration,CKD-EPI)公式计算eGFR。排除冠心病、肝癌等恶性肿瘤、糖尿病、急性肾功能不全、严重并发症患者。
1.2 方法
1.2.1 标本采集和处理
采集所有研究对象空腹12 h的清晨肘静脉血5 mL,加入内含惰性分离胶、促凝剂的真空采血管中,以3 500×g离心10 min,分离血清,-80 °C保存待检。
1.2.2 相关指标检测
采用瑞士罗氏公司的cobas c702全自动生化分析仪和配套试剂检测Lp(a)颗粒浓度(nmol/L),检测方法为乳胶增强免疫比浊法,参考区间上限为75 nmol/L,根据试剂说明书提供的转换因子,可将颗粒浓度转换为质量浓度,计算公式为:mg/L=(nmol/L+3.83)×4.587(新公式,2020年6月及以后);mg/L=nmol/L×4.167(旧公式,2020年6月前)。采用日本日立公司7600全自动生化分析仪和德国德赛公司 Lp(a)诊断试剂检测Lp(a)质量浓度(mg/L),检测方法为免疫比浊法,参考区间上限为300 mg/L。总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和肌酐(creatinine,Cr)的检测方法为酶法,高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)的检测方法为免疫比浊法,均采用cobas c702全自动生化分析仪和配套试剂进行检测。apo A1、apo B采用德国德赛公司试剂检测,apo E采用日本积水公司试剂检测,检测方法均为免疫透射比浊法,检测仪器为7600全自动生化分析仪。采用美国伯乐公司VariantIITurbo血红蛋白测试系统和配套试剂检测HbA1c,检测方法为离子交换高效液相色谱法。
1.3 统计学
采用SPSS 22.0软件进行统计学分析。正态分布的计量资料以x̅±s表示,多组间比较采用方差分。非正态分布的计量资料以中位数(M)[四分位数(P25,P75)]表示,组间比较采用Kruskal-Wallis检验。采用Spearman相关分析评价年龄、性别与Lp(a)浓度的相关性。采用Passing-Bablok回归分析和Bland-Altman偏移分析评估各组Lp(a)直接检测得到的质量浓度与通过颗粒浓度转换的质量浓度的一致性。以P<0.05为差异有统计学意义。
2 结果
2.1 各组基本临床资料比较
各组年龄、性别和实验室相关检测指标差异均有统计学意义(P<0.05)。见表1。
2.2 各组Lp(a)质量浓度与颗粒浓度的相关性
各组Lp(a)颗粒浓度与质量浓度检测结果的相关性较好。健康对照组Lp(a)颗粒浓度与质量浓度相关性最高(r=0.994 8,P<0.05)。疾病组中,颗粒浓度和质量浓度相关性最高的是冠心病组(r=0.976 3,P<0.05),相关性最低的是肝癌组(r=0.863 2,P<0.05)。见表3。
2.3 各组Lp(a)颗粒浓度和质量浓度阳性率比较
健康对照组、冠心病组、肝癌组Lp(a)颗粒浓度、质量浓度阳性率差异无统计学意义(P>0.05),慢性肾脏病组和糖尿病组Lp(a)颗粒浓度、质量浓度的阳性率差异有统计学意义(P<0.05)。见图1。
2.4 各组 Lp(a)质量浓度检测结果与转换结果的一致性
Passing-Bablok回归分析和Bland-Altman偏移分析结果显示,采用不同公式,各组的转换差异不同,各疾病组经新公式转换后的差异小于采用旧公式转换后的差异。各疾病组2种方法得到的质量浓度间的回归方程斜率的95%可信区间均不包含理论值。Bland-Altman相对偏移分析结果显示,不同亚组间2种方法得到的质量浓度的95%一致性界限均超过了1/2允许总误差。见图2~图6。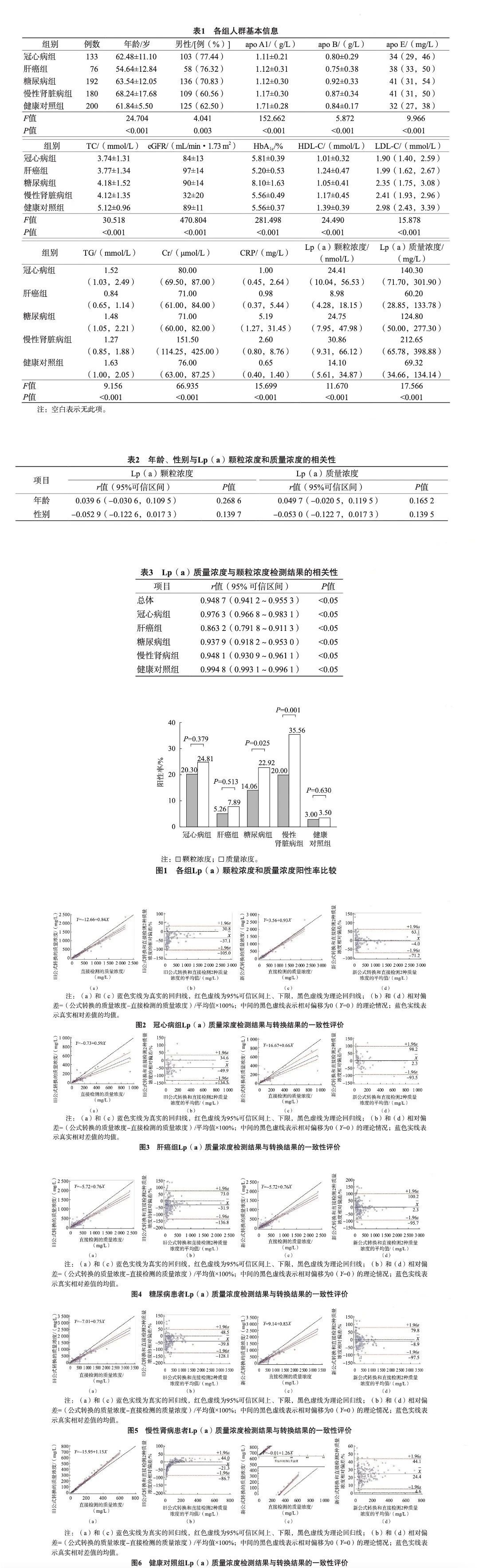
3 讨论
使用何种方法检测Lp(a)和用何种单位计量Lp(a)浓度一直是临床实验室面临的难题。不同方法Lp(a)检测结果的差异与apo(a)的结构和KIV重复序列的多态性有关。理想情况下,针对apo(a)中独特非重复表位的单克隆抗体能识别每个Lp(a)颗粒,可使用颗粒浓度(nmol/L)作为计量单位。但在实际工作中,由于制备这种抗体较为困难,很多检测方法使用的是识别不同表位的多克隆抗体,因此可能产生小分子亚型结果偏低或大分子亚型结果偏高的风险。2012年,瑞士罗氏公司用5份可溯源至SRM 2B参考物质和参考方法的新鲜人血清作为一级校准品和商品化校准品的溯源,一定程度上消除了apo(a)多态性对检测结果的影响,确定了与参考方法具有可比性的Lp(a)检测方法,并以nmol/L作为计量单位。
参考文献(略)
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设