
近日,中国营养保健食品协会发布了关于祝贺成立CFDA特殊食品注册管理司的消息,意味着国家食品药品监督管理总局又添新部门。4月7日国家食品药品监督管理总局发布2017年部门预算,该公告中对总局主要职责进行了概括。尽管如此,仍有很多新入行的医疗器械从业者们对监管部门及下设处室的职能划分不明晰,针对不同问题不知去哪个部门咨询。为了解决大家对监管部门机构职能的困惑,贴心的小编为大家整理了国家食品药品监督管理总局医疗器械相关职能部门及总局直属单位的介绍,需要的朋友们快快转走收藏!如有错漏,欢迎大家指正!


一、综合司
1)组织开展食品药品监督管理政策研究,分析研判食品药品安全形势,提出解决食品安全和药品管理问题的重大方针和政策建议。
2)协调推动完善食品药品监督管理体制机制,组织开展推动形成社会共治格局重大课题研究,探索发挥市场机制、社会监督和行业自律作用的有效途径,推动建立落实食品药品生产经营者第一责任人的有效机制以及食品安全责任强制保险制度。
3)负责组织建设食品药品监督管理政策研究体系,建立食品药品监督管理政策研究基地,搭建研究成果交流平台。
4)组织建立食品药品监督管理重大决策专家咨询制度。
二、法制司
1)拟订食品药品监督管理立法规划和计划,组织起草食品药品监督管理法律法规及部门规章草案。
2)负责总局食品药品监督管理规范性文件的合法性审核工作。组织对有关部门起草的法律法规、部门规章中涉及食品药品监督管理事项提出意见。
3)指导食品药品监督管理法制建设,组织开展食品药品监督管理执法监督工作。
4)织开展食品药品监督管理法律制度理论研究。
5)负责有关食品药品监督管理行政复议、行政应诉和听证工作。
1、法规二处
1)承担医疗器械监督管理相关法律法规及部门规章草案,以及有关规范性文件的合法性审核工作。
2)组织对有关部门起草的法律法规、部门规章中医疗器械监督管理事项提出意见。
3)配合有关部门承办医疗器械监督管理有关法律法规及部门规章的解释工作。
三、医疗器械注册管理司
1)组织拟订医疗器械注册管理制度并监督实施。
2)组织拟订医疗器械标准、分类规则、命名规则和编码规则。
3)严格依照法律法规规定的条件和程序办理境内第三类、进口医疗器械产品注册、高风险医疗器械临床试验审批并承担相应责任,优化注册管理流程,组织实施分类管理。
4)组织开展医疗器械临床试验机构资质认定,监督实施医疗器械临床试验质量管理规范,监督检查临床试验活动。
5)指导督促医疗器械注册工作相关的受理、审评、检测、检查、备案等工作。
6)拟订医疗器械注册许可工作规范及技术支撑能力建设要求并监督实施。督促下级行政机关严格依法实施第一、二类医疗器械产品注册、境内第三类医疗器械不改变产品内在质量的变更申请许可等工作,履行监督管理责任,及时发现、纠正违法和不当行为。
1、综合处
1)承担医疗器械注册管理信息化相关工作。
2)组织开展医疗器械注册管理相关统计等工作。
3)组织拟订地方承担的医疗器械注册相关技术支撑体系及能力建设要求。
4)组织开展医疗器械注册管理政策研究的基础性工作,研究分析医疗器械注册管理形势、存在问题并提出措施建议。
5)组织开展对下级行政机关医疗器械注册相关工作的督促检查,及时发现、纠正违法和不当行为。
2、注册一处
1)组织拟订有源医疗器械、体外诊断试剂注册管理制度、标准、注册技术审查指导原则和需要进行临床试验审批的第三类医疗器械目录并监督实施,承担相关申请注册产品的分类界定。
2)承担境内第三类和进口的有源医疗器械、体外诊断试剂注册、有关高风险医疗器械、体外诊断试剂临床试验审批工作。
3)指导督促下级行政机关有关境内有源第一、二类医疗器械、体外诊断试剂注册以及境内第三类不改变产品内在质量变更申请许可等工作。
3、注册二处
1)组织拟订无源医疗器械注册管理制度、标准、注册技术审查指导原则和需要进行临床试验审批的第三类医疗器械目录并监督实施,承担相关申请注册产品的分类界定。
2)承担境内第三类和进口无源医疗器械注册、有关高风险医疗器械临床试验审批。
3)组织拟订医疗器械分类规则、分类目录、命名规则和编码规则。
4)指导督促下级行政机关有关境内无源第一、二类医疗器械注册以及境内第三类不改变产品内在质量变更申请许可等工作。
4、研究监督处
1)拟订医疗器械临床试验质量管理规范、临床试验指导原则并监督实施。
2)拟订医疗器械临床试验机构资质认定、管理制度并组织实施,监督检查临床试验活动。
3)组织开展医疗器械注册现场核查工作。
四、医疗器械监管司
1)掌握分析医疗器械安全形势、存在问题并提出完善制度机制和改进工作的建议。
2)组织拟订医疗器械生产、经营、使用管理制度并监督实施,组织拟订医疗器械生产、经营、使用质量管理规范并监督实施。拟订医疗器械互联网销售监督管理制度并监督实施。
3)组织开展对医疗器械生产经营企业和使用环节的监督检查,组织开展医疗器械不良事件监测和再评价、监督抽验及安全风险评估,对发现的问题及时采取处理措施。
4)拟订境外医疗器械生产企业检查等管理制度并监督实施。组织开展有关医疗器械产品出口监督管理事项。
5)拟订问题医疗器械召回和处置制度,指导督促地方相关工作。
1、综合处
1)组织研究分析医疗器械安全形势、存在问题并提出措施建议。
2)开展医疗器械监督管理制度研究并提出措施建议。
3)承担医疗器械监督管理信息化相关工作。
4)组织开展医疗器械监督管理相关统计等工作。
5)组织开展有关指定医疗器械产品出口监督管理和出口医疗器械销售证明书相关工作。
2、生产监管处
1)组织开展有关指定医疗器械产品出口监督管理和出口医疗器械销售证明书相关工作。
2)拟订医疗器械生产质量管理规范、生产许可管理制度并监督实施。
3)拟订医疗器械生产企业分类管理制度并监督实施。
4)组织开展对医疗器械生产企业的监督检查,及时对违法违规行为采取处理措施,指导督促地方相关召回和处置工作。
5)拟订医疗器械生产企业监督管理工作规范,组织开展对下级行政机关医疗器械生产监督管理相关工作的督促检查,及时发现、纠正违法和不当行为。
6)拟订境外医疗器械生产企业检查等管理制度并监督实施。
3、流通监管处
1)掌握分析医疗器械流通使用安全形势、存在问题并提出完善制度机制和改进工作的建议。
2)拟订医疗器械经营、使用质量管理规范和经营许可管理制度并监督实施。
3)拟订医疗器械经营企业分类管理制度并监督实施。
4)组织开展对医疗器械经营企业的监督检查,及时对违法违规行为采取处理措施,指导督促地方相关召回和处置工作。
5)拟订医疗器械互联网销售监督管理制度并监督实施。
6)组织开展使用环节医疗器械质量安全监督检查。
7)拟订医疗器械经营企业、使用单位监督管理工作规范,组织开展对下级行政机关医疗器械经营、使用监督管理相关工作的督促检查,及时发现、纠正违法和不当行为
4、监测评价处
1)拟订医疗器械不良事件监测和再评价管理制度并监督实施。
2)组织开展上市后医疗器械不良事件监测、再评价及安全风险评估,起草医疗器械安全信息公告。
3)组织并指导开展医疗器械质量监督抽验,拟订国家医疗器械质量监督抽验计划并组织实施,拟订国家医疗器械质量公告。
4)拟订医疗器械监督管理技术支撑能力建设要求,完善技术支撑保障体系。
5)拟订问题医疗器械召回和处置制度,指导督促相关工作。
6)参与重大医疗器械不良事件相互通报机制和联合处置机制工作。
五、稽查局
1)组织拟订食品药品稽查工作制度并监督实施。
2)协调指导食品药品安全投诉举报工作。
3)指导监督地方稽查工作,规范行政执法行为。
4)建立和完善食品药品安全“黑名单”制度。
5)建立健全食品药品监督管理行政执法与刑事司法衔接制度。
6)组织查处重大食品药品安全违法案件,组织开展相关的执法检验。
7)拟订医疗器械广告审查制度并监督实施。
8)承担打击侵犯知识产权和假冒伪劣商品相关工作。
1、稽查三处
1)组织落实医疗器械稽查工作制度并监督实施。
2)建立和完善医疗器械安全“黑名单”制度。
3)组织查处重大医疗器械安全违法案件,组织开展相关的执法检测。
4)掌握分析医疗器械广告监督工作形势、存在问题并提出意见建议。
5)组织拟订医疗器械广告审查办法和审查规范,开展相关的广告监测,并监督实施。
6)指导监督地方广告审查监督和医疗器械稽查工作,规范行政执法行为。
六、应急管理司
1)组织拟订食品药品安全应急体系建设规划,推动应急体系建设和能力建设。
2)组织拟订食品药品安全应急管理工作制度并监督实施。
3)组织编制食品药品安全事故应急预案,开展应急培训和演练。
4)织开展食品药品安全信息搜集和舆情监测,指导协调核查、应对工作。
5)建立食品药品重大信息直报制度并监督实施。
6)核查领导批示、媒体披露和公众举报的食品药品安全事故,及时报告或协调回应。
7)负责建立食品药品应急管理专家组,开展食品药品安全舆情和重大事故案例研究,分析相关风险趋势及突发事件发生态势,提出对策建议。
8)协调建立重大医疗器械不良事件相互通报机制和联合处置机制。
9)承办总局交办的其他事项。
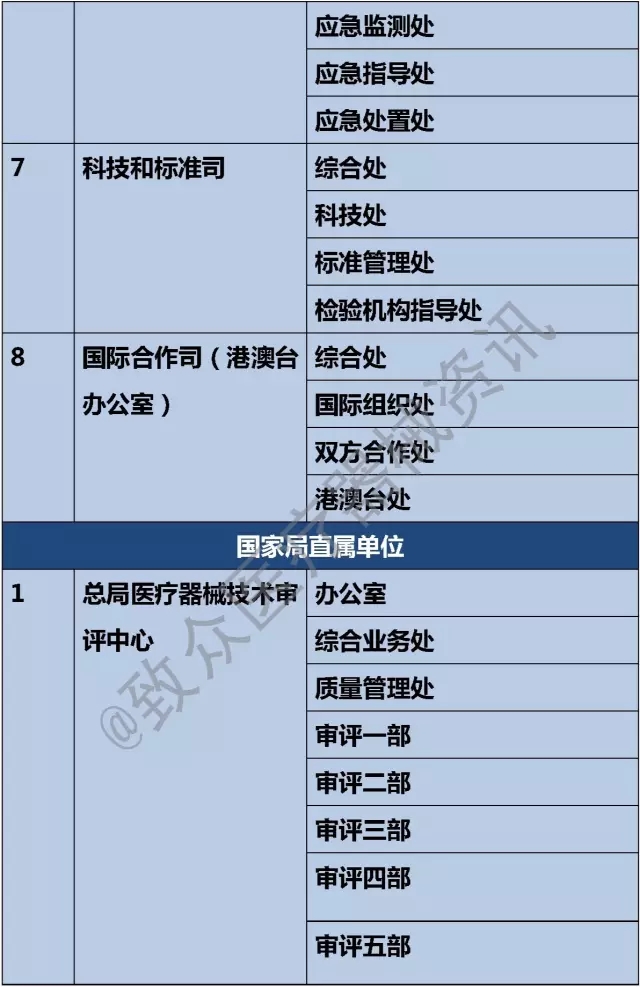
七、科技和标准司
1)组织拟订食品药品监督管理科研规划和计划,推动科技创新体系建设,承担相关科技条件建设工作。
2)组织实施食品药品监督管理重大科技项目,组织引进国外相关先进技术,指导科研、管理与生产经营单位技术协作,促进科技成果转化。
3)推动食品药品检验检测体系建设,拟订食品药品检验检测机构资质认定条件和检验规范并监督实施。
4)推动食品药品电子监管追溯体系和信息化建设。
5)建立完善有关医疗器械标准管理的相关制度和工作机制。
6)组织拟订药用辅料、直接接触药品的包装材料和容器产品目录、药用要求、标准的管理规范。
7)指导地方科技和标准管理工作。
8)拟订互联网药品交易服务企业管理制度并监督实施。承担互联网药品交易服务企业有关行政审批工作。
1、标准管理处
1)拟订医疗器械标准管理制度,推动建立标准管理工作机制,完善相关标准管理体系。
八、国际合作司(港澳台办公室)
1)组织拟订食品药品安全国际交流与合作中长期发展规划和年度计划并组织实施。
2)组织开展食品药品监督管理国际交流与合作,指导地方相关工作。
3)组织开展与港澳台地区的食品药品监督管理交流与合作。
4)组织开展食品药品监督管理国际交流与合作的政策研究和信息分析。
5)协助开展食品药品监督管理业务相关的境外检查。
6)组织开展智力引进和出国(境)培训工作。
国家局直属单位
一、总局医疗器械技术审评中心
1)负责对申请注册的首次进口医疗器械产品进行技术审评。
2)负责对医疗器械新产品和申请注册的境内医疗器械第三类产品试产和准产进行技术审评。
3)负责对医疗器械临床试验申报材料进行技术审查,接受临床试验方案的备案,组织起草专项临床试验方案规定。
4)组织开展相关的业务培训及咨询服务。
1、综合业务处
1)负责中心审评业务工作分派、日常管理和协调。
2)组织开展创新医疗器械特别审批申请的审查工作。
3)负责相关医疗器械产品注册资料的接受和运转、审评资料管理和档案查询工作。
4)承担审评咨询专家库的日常管理工作,组织筹备各类审评会议。
5)组织协调医疗器械注册核查工作。
2、质量管理处
1)组织开展相关医疗器械产品注册技术审评规范以及审评质量管理规章制度的制修订工作并监督实施。
2)承担审评业务工作质量和效率的监督管理和绩效评价。
3)组织开展相关业务咨询服务及学术交流活动。
4)组织开展相关医疗器械产品技术审评政策研究。
5)组织协调地方医疗器械技术审评工作的业务指导和技术支持。
3、审评一部
1)负责对申请注册的医用X射线设备及医用磁共振设备等有源医疗器械产品进行技术审评。
2)组织起草并实施相关专业医疗器械产品技术审评指导原则。
4、审评二部
1)负责对申请注册的医用超声及医用激光仪器设备等有源医疗器械产品进行技术审评。
2)组织起草并实施相关专业医疗器械产品技术审评指导原则。
5、审评三部
1)负责对申请注册的血管支架、人工晶体、乳房植入物等植入材料和人工器官等无源医疗器械产品进行技术审评。
2)组织起草并实施相关专业医疗器械产品技术审评指导原则。
6、审评四部
1)负责对申请注册的骨科器械和口腔材料等无源医疗器械产品进行技术审评。
2)组织起草并实施相关专业医疗器械产品技术审评指导原则。
7、审评五部
1)负责对申请注册的注射穿刺器械及医用高分子材料及制品等无源医疗器械产品进行技术审评。
2)组织起草并实施相关专业医疗器械产品技术审评指导原则。
8、审评六部
1)负责对申请注册的临床检验仪器及体外诊断试剂进行技术审评。
2)组织起草并实施相关专业产品审评指导原则。
二、中国食品药品检定研究院(总局医疗器械标准管理中心)
1)承担医疗器械的注册审批检验及其技术复核工作,承担保健食品、化妆品审批所需的检验检测工作,负责进口药品注册检验及其质量标准复核工作。
2)承担医疗器械相关的监督检验、委托检验、抽查检验以及安全性评价检验检测工作
3)承担或组织医疗器械检验检测的复验及技术检定工作。
4)承担生物制品批签发相关工作。
5)承担医疗器械相关标准、技术规范及要求、检测方法制修订的技术复核与验证工作。
6)负责医疗器械国家标准物质的研究、制备、标定、分发和管理工作。
7)负责生产用菌毒种、细胞株的检定工作,承担医用标准菌毒种、细胞株的收集、鉴定、保存、分发和管理工作。
8)承担实验动物质量检测和实验动物保种、育种和供种工作。
9)承担有关医疗器械广告的技术监督工作。
10)承担全国食品药品监管系统检验检测机构的业务指导、规划和统计等相关工作,组织开展药品研究、生产、经营相关单位以及医疗机构中的药品检验检测机构及人员的业务指导工作。
11)组织开展医疗器械相关标准研究以及安全监测和质量控制新方法、新技术研究。
12)承担严重医疗器械不良事件原因的实验研究。
13)组织开展医疗器械相关检验检测工作的国际交流与合作。
1、医疗器械检定所
i生物材料和组织工程室
1)负责植入材料、人工器官、组织工程产品、介入材料、医用卫生材料等无源医疗器械的理化性能和生物性能检验;
2)负责相关医疗器械国家标准和行业标准的制修订工作;
3)参与相应品种国家标准物质的研制与标定;
4)开展相应技术方法研究及技术人员培训。
ii光机电室
1)负责无源医用光学器具、有源眼科光学仪器、医用激光仪器设备以及有源机电类医疗器械和医用软件等领域的医疗器械检验;
2)负责相关医疗器械国家标准和行业标准的制修订工作;
3)负责相应品种国家标准物质的研制与标定;
4)开展相应技术方法研究及技术人员培训。
iii体外诊断试剂一室
1)负责以非传染病诊断试剂为主的各种体外诊断试剂的检验及有关国家标准和行业标准的制修订工作;
2)参与相应品种国家标准物质的研制与标定;
3)开展相应技术方法研究及技术人员的培训;
iv体外诊断试剂二室
1)负责以传染病诊断试剂为主的各种体外诊断试剂的检验及有关国家标准和行业标准的制修订工作;
2)参与相应品种国家标准物质的研制与标定;
3)开展相应技术方法研究及技术人员的培训;
v标准研究室
1)负责医疗器械产品标准技术委员会秘书处的日常工作;
2)组织协调标准制修订的相关工作;
3)负责所内相关科研管理工作;
4)承担与标准相关的国际合作研究与活动。
2、实验动物资源研究所
1)承担实验动物保种、育种、生产和供应工作
2)负责实验期动物饲养管理及相关条件保障
3)负责实验动物质量和实验环境设施与设备检测
4)负责动物源性材料病毒安全性检测和病毒灭活效果验证
5)开展转基因动物和动物模型研发
6)开展与实验动物相关新技术、新方法研究
7)承担“国家啮齿类实验动物种子中心”、“国家实验动物质量检测中心”工作
3、医疗器械标准管理研究所
1)承担医疗器械标准拟定的相关事务性工作
2)组织协调相关医疗器械专业标准化技术委员会开展医疗器械标准制修订工作
3)组织开展医疗器械标准体系研究,提出标准工作政策及规划建议
4)承担医疗器械命名、分类和编码技术研究工作
5)承担全国医疗器械标准相关机构的业务指导工作
4、生物制品检定所
1)承担生物制品注册检验、监督检验、委托检验、口岸检验以及相关检验检测的复验和技术检定等工作
2)负责生物制品新药和进口生物制品的注册检验、质量标准复核以及国家标准制修订的技术复核与验证工作
3)承担生物制品批签发具体技术工作
4)承担生物制品标准物质研究和标定工作
5)承担生产用菌毒种、细胞株的检定以及医用标准菌毒种、细胞株的收集、鉴定、保存、分发和管理工作
6)开展与生物制品检验方法、质量标准等相关新方法、新技术研究
7)承担“国家病毒性肝炎研究中心”、“中国医学细菌菌种保藏管理中心”工作
5、标准物质与标准化研究所
1)承担医疗器械国家标准物质管理工作。
2)负责组织医疗器械等标准物质研究、制备、标定、审核和分发等工作。
3)负责相关培养基制备及供应工作。
4)组织开展医疗器械相关质量标准、快检技术等方面的新技术、新方法以及新检测仪器的标准化研究工作。
6、食品药品技术监督所
1)承担医疗器械质量监督抽验和监督调查工作。
2)拟订医疗器械年度抽验方案,汇总、分析、上报抽验数据,拟订质量公告。
3)承担医疗器械等有关广告和互联网药品信息服务等技术监督工作。
三、总局食品药品审核查验中心
1)组织制定医疗器械审核查验工作的技术规范和管理制度。参与制定医疗器械相关质量管理规范及指导原则等技术文件。
2)组织开展药品注册现场核查相关工作。开展医疗器械相关质量管理规范的合规性核查、临床试验项目现场核查以及有因核查。组织开展医疗器械质量管理规范相关的飞行检查。
3)承担相关国家核查员的聘任、考核、培训等日常管理工作,指导地方核查员队伍建设。
4)指导地方医疗器械审核查验相关工作,开展审核查验机构能力评价相关工作。
5)开展医疗器械审核查验相关的理论、技术和发展趋势研究。组织开展相关审核查验工作的学术交流和技术咨询。
6)组织开展医疗器械相关境外核查工作。承担审核查验相关的国际交流与合作工作。
1、研究核查处
1)参与制修订药物医疗器械临床试验质量管理规范及相关指导原则等技术文件。
2)开展药物临床试验机构的合规性核查和相关药物医疗器械临床试验项目的现场核查和有因核查工作。
3)承担药物研究国家核查员的考核和培训。
4)指导和评价地方核查相关工作。
2、医疗器械核查处
1)组织制修订医疗器械审核查验工作的技术规范和管理制度并指导实施。
2)参与制修订医疗器械生产、经营质量管理规范及相关指导原则等技术文件。
3)开展医疗器械相关质量管理规范的合规性核查。
4)组织开展医疗器械研制、生产、经营环节的飞行检查。
5)承担医疗器械国家核查员的考核和培训。
3、国际核查处
1)参与制修订医疗器械境外核查管理制度、相关指导原则并组织实施。
2)组织开展医疗器械研究、生产的境外核查工作。
四、总局药品评价中心(国家药品不良反应监测中心)
1)组织制订医疗器械不良事件监测与再评价的技术标准和规范。
2)组织开展医疗器械不良事件监测工作。
3)开展医疗器械的安全性再评价工作。
1、医疗器械部
1)组织制订医疗器械不良事件监测与再评价的技术标准和规范。
2)开展医疗器械不良事件监测工作。
3)承担医疗器械不良事件报告的收集、评价、反馈和上报工作。
4)组织开展医疗器械安全性再评价工作。
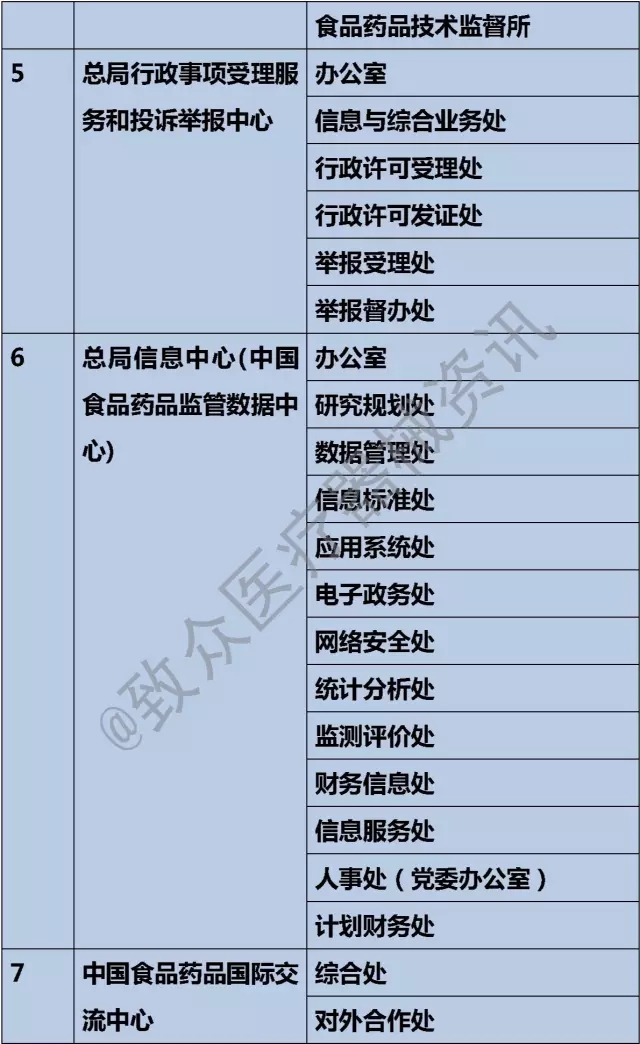
五、总局行政事项受理服务和投诉举报中心
1)受理医疗器械研制、生产、流通、使用方面违法行为的投诉举报。
2)参与医疗器械行政许可项目受理审批及投诉举报相关法规和规范性文件的起草与制修订工作。
3)转办医疗器械投诉举报案件。
4)开展医疗器械投诉举报信息的汇总、分析、上报工作,负责重大投诉举报案件办理工作的组织协调、跟踪督办,并监督处理结果的反馈。
5)指导协调地方食品药品行政许可项目受理及投诉举报工作。
6)指导协调地方食品药品行政许可项目受理及投诉举报工作。
六、总局信息中心(中国食品药品监管数据中心)
1)参与起草国家食品药品监督管理信息化建设发展规划;组织开展食品药品监管信息政策研究;承担国家食品药品监管信息化重点工程、重大项目的申报和实施相关工作。
2)研究建立国家食品药品监管信息化标准体系;指导地方食品药品监管系统信息化相关业务工作。
3)负责中国食品药品监管数据中心的建设;承担食品药品监管信息数据的采集、整理、存储、分析、利用、监测、评价等管理工作。
4)承担国家食品安全和药品安全信息平台建设;组织推进食品药品监管业务应用信息系统建设。
5)承担食品药品监管统计业务工作,健全统计指标体系,开展数据采集、汇总、分析工作,编辑和提供统计资料。
6)研究开发食品药品信息产品,通过网络、期刊及其他技术交流与合作方式,面向系统、社会和行业开展信息服务。
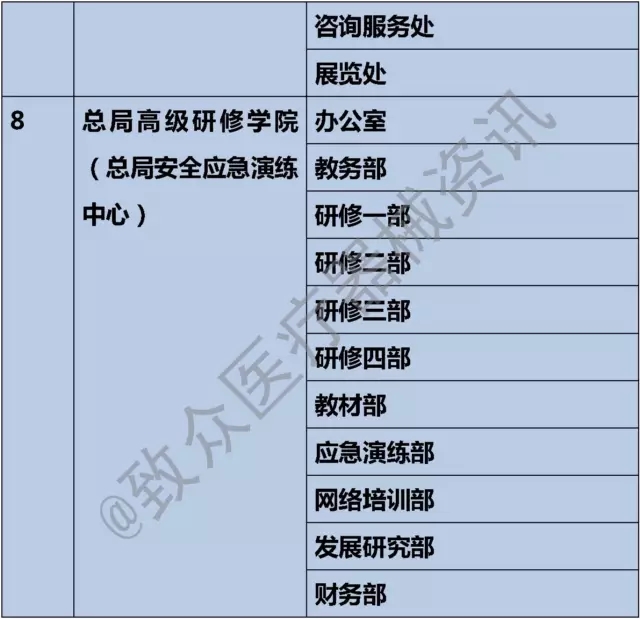
七、总局高级研修学院(总局安全应急演练中心)
1)负责省、市(地)、县各级食品药品监管部门行政监管和技术监督机构负责人国家级轮训及各类中高级专业技术人员专门业务培训;依照《公务员法》开展公务员初任、任职、在职及专门业务培训;实施公务人员高级研修。
2)承担食品药品安全应急培训与演练的有关工作,开展相关科研、咨询和交流合作等。
3)组织开展执业药师考前培训、继续教育、师资培训及相关工作;组织开展食品药品行业食品药品安全关键岗位从业人员职业(工种)技能鉴定相关工作。
4)协助国家食品药品监督管理总局开展食品药品监管政策理论研究及人才队伍发展战略研究工作。
5)协助国家食品药品监督管理总局指导地方教育培训业务工作。
1、研修四部
1)承担医疗器械监管教育培训教学研究、课题开发、教学实施方案的制订及授课等工作。
2)开展医疗器械安全专业技术人员培训工作。
八、中国食品药品国家交流中心
1)围绕国家食品药品监督管理工作职能和重点工作,开展有关国际交流与合作,组织开展内地同港、澳、台地区医药界的交流与合作。
2)承担国外来访医药相关团组及人员的接待工作;组织医药界及有关人员赴国(境)外考察、培训。
3)举办医药、医疗器械、保健品等国际展览和会议,并开展相关的技术交流、咨询服务。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设