
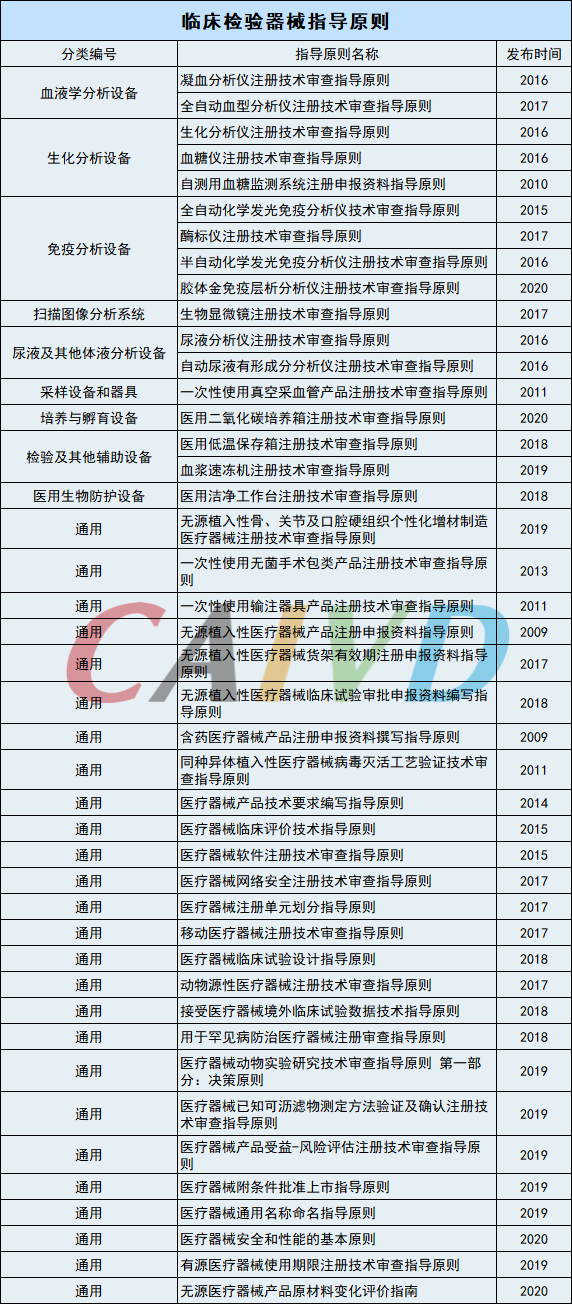
临床检验器械包括用于临床检验实验室的设备、仪器、辅助设备和器具及医用低温存贮设备,不包括体外诊断试剂。
自2011年起,国家相关部门已发布44项临床检验器械注册技术审查指导原则。目前已发布的指导原则涵盖了血液、生化、免疫、系统、体液、辅助等。小编整理如下:
![]() 1.凝血分析仪注册技术审查指导原则(2016年修订版).doc
1.凝血分析仪注册技术审查指导原则(2016年修订版).doc
![]() 3.生化分析仪注册技术审查指导原则(2016年修订版).doc
3.生化分析仪注册技术审查指导原则(2016年修订版).doc
![]() 8.半自动化学发光免疫分析仪注册技术审查指导原则(2016年修订版).doc
8.半自动化学发光免疫分析仪注册技术审查指导原则(2016年修订版).doc
![]() 9.胶体金免疫层析分析仪注册技术审查指导原则(2020年第14号).docx
9.胶体金免疫层析分析仪注册技术审查指导原则(2020年第14号).docx
![]() 11.尿液分析仪注册技术审查指导原则(2016年修订版).doc
11.尿液分析仪注册技术审查指导原则(2016年修订版).doc
![]() 12.自动尿液有形成分分析仪注册技术审查指导原则(2016年修订版).doc
12.自动尿液有形成分分析仪注册技术审查指导原则(2016年修订版).doc
![]() 14.医用二氧化碳培养箱注册技术审查指导原则(2020年第39号).doc
14.医用二氧化碳培养箱注册技术审查指导原则(2020年第39号).doc
![]() 16.血浆速冻机注册技术审查指导原则(2019年第79号).doc
16.血浆速冻机注册技术审查指导原则(2019年第79号).doc
![]() 18.无源植入性骨、关节及口腔硬组织个性化增材制造医疗器械注册技术审查指导原则(2019年第70号).doc
18.无源植入性骨、关节及口腔硬组织个性化增材制造医疗器械注册技术审查指导原则(2019年第70号).doc
![]() 19.一次性使用无菌手术包类产品注册技术审查指导原则.doc
19.一次性使用无菌手术包类产品注册技术审查指导原则.doc
![]() 23.无源植入性医疗器械临床试验审批申报资料编写指导原则.doc
23.无源植入性医疗器械临床试验审批申报资料编写指导原则.doc
![]() 25.同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则.doc
25.同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则.doc
![]() 33.动物源性医疗器械注册技术审查指导原则(2017年修订版).doc
33.动物源性医疗器械注册技术审查指导原则(2017年修订版).doc
![]() 36.医疗器械动物实验研究技术审查指导原则 第一部分:决策原则(2019年第18号).doc
36.医疗器械动物实验研究技术审查指导原则 第一部分:决策原则(2019年第18号).doc
![]() 37.医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则(2019年第78号).doc
37.医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则(2019年第78号).doc
![]() 38.医疗器械产品受益-风险评估注册技术审查指导原则(2019年第79号).docx
38.医疗器械产品受益-风险评估注册技术审查指导原则(2019年第79号).docx
![]() 39.医疗器械附条件批准上市指导原则(2019年第93号).doc
39.医疗器械附条件批准上市指导原则(2019年第93号).doc
![]() 40.医疗器械通用名称命名指导原则(2019年第99号).doc
40.医疗器械通用名称命名指导原则(2019年第99号).doc
![]() 41.医疗器械安全和性能的基本原则(2020年第18号).doc
41.医疗器械安全和性能的基本原则(2020年第18号).doc
![]() 42.有源医疗器械使用期限注册技术审查指导原则(2019年第23号).doc
42.有源医疗器械使用期限注册技术审查指导原则(2019年第23号).doc
![]() 43.无源医疗器械产品原材料变化评价指南(2020年第33号).doc
43.无源医疗器械产品原材料变化评价指南(2020年第33号).doc
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设