热门搜索:分会介绍 | 会员名单 | 行业资讯

国家药品监督管理局医疗器械技术审评中心于2022年11月10日公开《乙型肝炎病毒RNA(HBV-RNA)测定试剂盒(PCR-荧光探针法)》产品注册技术审评报告,申请人:北京热景生物技术股份有限公司。
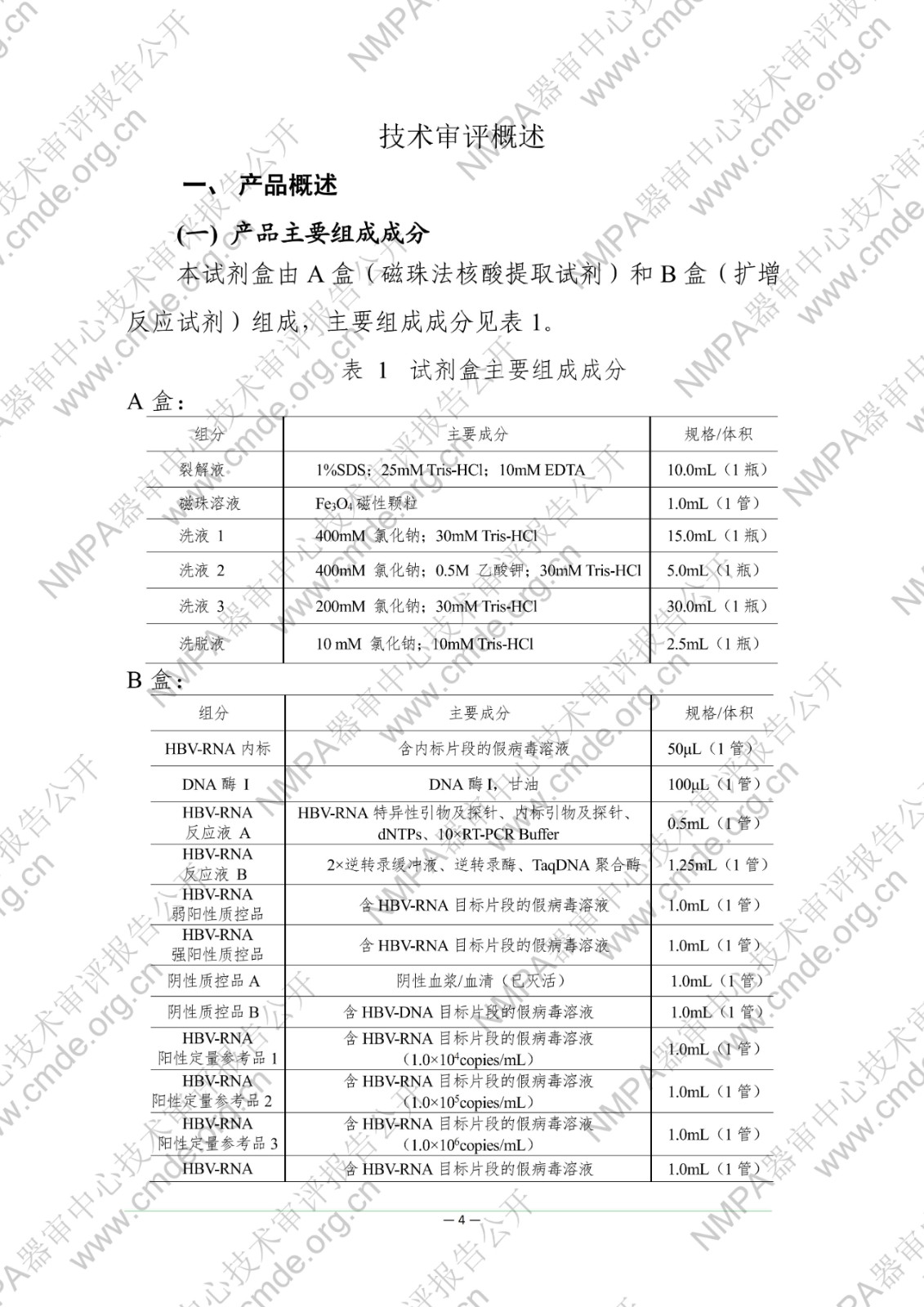
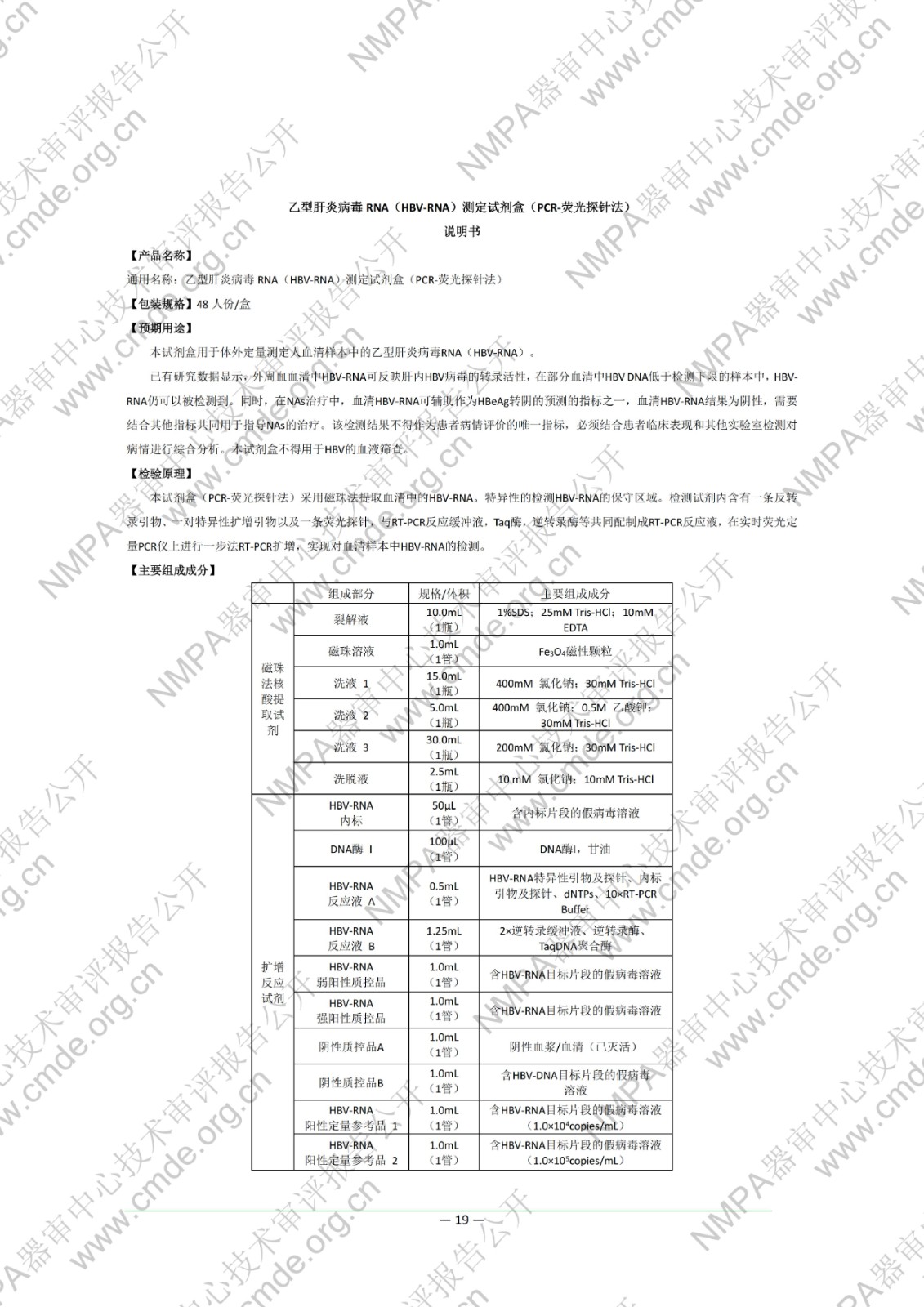
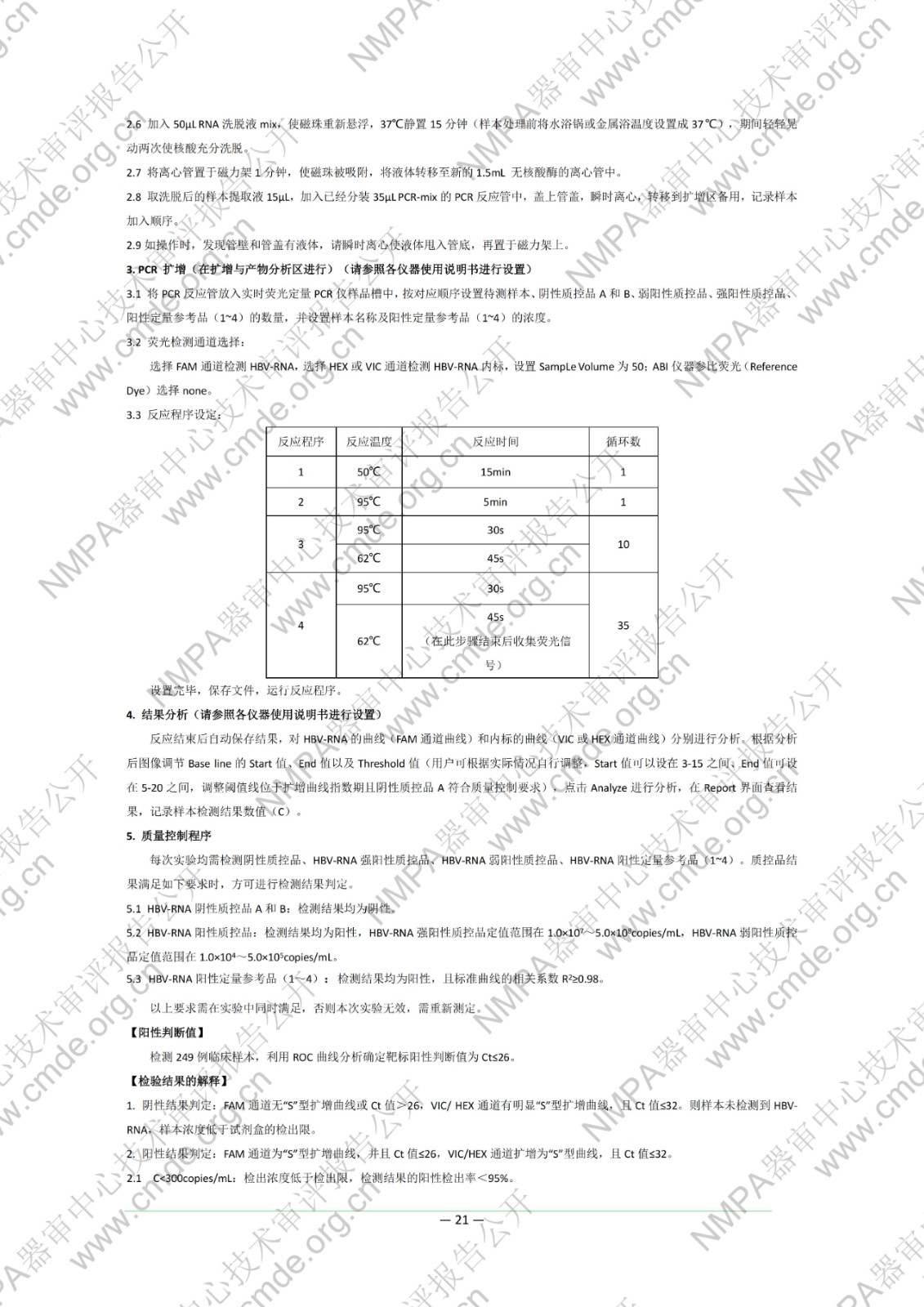
本试剂盒用于体外定量测定人血清样本中的乙型肝炎病毒 RNA(HBV-RNA)。已有研究数据显示,外周血血清中 HBV-RNA 可反映肝内HBV 病毒的转录活性,在部分血清中 HBV DNA 低于检测下限的样本中,HBV-RNA 仍可以被检测到。同时,在 NAs 治疗中,血清 HBV-RNA 可辅助作为 HBeAg 转阴的预测的指标之一,血清 HBV-RNA 结果为阴性,需要结合其他指标共同用于指导NAs 的治疗。该检测结果不得作为患者病情评价的唯一指标,必须结合患者临床表现和其他实验室检测对病情进行综合分析。本试剂盒不得用于 HBV 的血液筛查。




















来源:CMDE
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设