热门搜索:分会介绍 | 会员名单 | 行业资讯

根据《医疗器械临床试验机构条件和备案管理办法》,自2018年1月1日至2018年12月31日,医疗器械临床试验申办者可以继续选择经食品药品监管总局会同国家卫生计生委认定的药物临床试验机构开展临床试验。自2019年1月1日起,医疗器械(包括体外诊断试剂)临床试验申办者应当选取已经在备案系统备案的医疗器械临床试验机构。
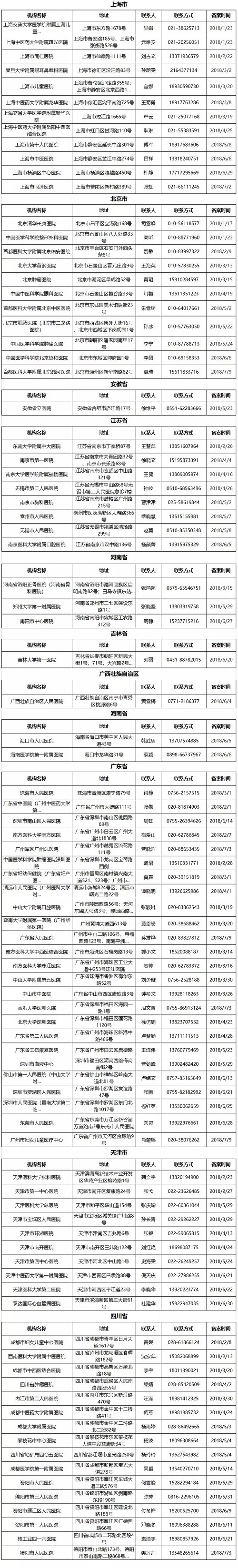
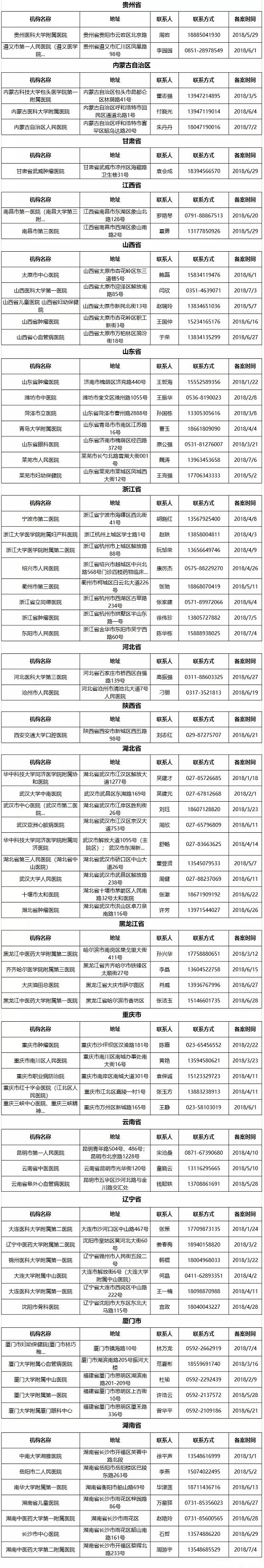
《医疗器械临床试验机构条件和备案管理办法》实施以来,截至目前已有160家医疗器械临床试验机构先后备案成功,以下是成功备案的机构信息。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设