
第四章 分子病理检测技术及产品的发展
概述
外科肿瘤病理学发源于19世纪后叶的欧洲。随着当时外科手术学的发展,外科医生们开始开展肿瘤术前活检,并把它做为一项必需的诊断手段。到19世纪90年代,冰冻切片技术的发明使术中活检成为可能,更进一步推动了外科肿瘤病理学的发展。到20世纪末,外科病理学的发展主要经历了两座里程碑:20世纪30年代,电镜的发明使病理医生能够观察细胞的超微结构。20世纪50年代,免疫组织化学技术被应用于诊断病理学,使病理医生能进一步观察细胞,特别是细胞的起源。20世纪70年代初,随着细胞生物学和分子生物学的发展,病理学与上述学科相互渗透而形成了新的分支学科-分子病理学,由于其在蛋白质和核酸等生物大分子水平上,应用分子生物学理论,技术及方法研究疾病发生发展的过程,从而给传统病理学注入了生机。分子病理是传统病理的补充和延伸,是分子生物学技术与肿瘤病理诊断相结合的产物。可想而知它所包含的检查范围很广,并且随着分子生物学技术的更新而在不断的改进中。下面就几种常用检测手段具体展开讨论。
第一节 染色体分析
染色体组型分析是细胞遗传学研究的基本方法,是研究物种演化、分类以及染色体结构、形态与功能之间关系所不可缺少的重要手段。通过染色体核型分析,可以根据染色体结构和数目的变异情况来判断生物是否患有某种因染色体片段缺失、重复或倒置等引起的遗传病。
越来越多的肿瘤,特别是骨关节、软组织和淋巴造血系统的肿瘤,已被发现有特异的染色体异常。所以对肿瘤细胞的染色体分析在很多时候成为诊断这些肿瘤的金标准。比如说,70%~95%的滤泡型淋巴瘤有特异性的14号染色体与18号染色体的易位。WHO制定的恶性血液病分型系统中,将染色体核型作为最重要的分型及诊断指标,发现重现性异常的染色体可提前作出AML的诊断。很多染色体异常导致特异性的白血病融合基因。染色体分析除用于各类恶性血液病患者,如急、慢性白血病、MDS、MPNs、淋巴瘤、多发性骨髓瘤(MM)患者外,还可用于儿童遗传性疾病、先天性畸形的染色体检测,以及习惯性流产、不孕不育等疾病的诊断。
染色体核型分析技术,传统上是观察染色体形态。但随着新技术的发现与应用,染色体核型分析变得越来越现代化,很多软件系统的完善也使核型分析结果越来越精确。染色体核型分析三大技术包括:GRQ带技术、荧光原位杂交技术、光谱核型分析技术。
1.GRQ带技术
人类染色体用Giemsa染料染色呈均质状,但是如果染色体经过变性和(或)酶消化等不同处理后,再染色可呈现一系列深浅交替的带纹,这些带纹图形称为染色体带型。显带技术就是通过特殊的染色方法使染色体的不同区域着色,使染色体在光镜下呈现出明暗相间的带纹。每个染色体都有特定的带纹,甚至每个染色体的长臂和短臂都有特异性。根据染色体的不同带型,可以更细致而可靠地识别染色体的个性。染色体特定的带型发生变化,则表示该染色体的结构发生了改变。一般染色体显带技术有G显带(最常用),Q显带和R显带等。G带技术是其中最常用的技术 ,由Pardue等人于1970年建立,G带反应了染色体DNA上AT的丰富区,在人类中约有2000条G带可被鉴别。G带不仅稳定且用扫描电镜可在带区见到收缩的痕迹。现在已制成人类的G带标准图谱,可用于鉴定染色体号数以及基因定位。Q带是在 1968年由 Caspersson等人建立的。R带是和 G带相反的带,也就是反带的意思,这种方法由Dutrillaux等人1971年建立。
2.荧光原位杂交技术
荧光原位杂交(fluorescence insitu hybridization, FISH)是在20世纪80年代末在放射性原位杂交技术的基础上发展起来的一种非放射性分子细胞遗传技术,以荧光标记取代同位素标记而形成的一种新的原位杂交方法,探针首先与某种介导分子结合,杂交后再通过免疫细胞化学过程连接上荧光染料。最早应用荧光原位杂交是在 1980 年 ,当时直接用荧光在 RNA 3′端标记,作为探针来检测特定 DNA 序列。联合氨基基质,能够耦联任何半抗原或者荧光团。用简单的化学分析就可以检测低信号探针,这对原位技术的发展很重要。探针的特异性,影响了FISH中低拷贝数量核酸的检测。间接标记杂交探针,可以使非直接检测的信号放大。在20世纪80年代初期,用生物素标记探针,然后用链球菌抗生物素蛋白荧光素级联放大检测DNA。大约10年之后,含有大量荧光分子的杂交探针经化学处理后,可以进行直接检测。20世纪 90年代,为同时检测更多的种类,科研工作者开辟了新的研究方向。起初,运用的是成像显著的光谱荧光团,后来人们开始用两种编码方法来改进它:特定核酸可以用二元颜色化合物来鉴定。这样每个染色体、基因或者转录过程就被截然不同的荧光信号所表示;使用比率相同的编码,用同一种颜色的混合物,依据对全部信号每一种颜色的相对变化,来描绘多种靶目标。采用一种方法和同时用两种一样,已经提高了许多核酸同时检测的数量 。
FISH作为定位特定核酸序列的检测方法 ,在过去的20年里不断发展。其初期的发展是扩大探针的种类和靶目标的数量,今后荧光技术的发展是扩展研究学科的种类。由于涉及很多领域,操作容易以及相关学科知识的快速增长,所以 FISH的使用非常广泛。虽然基本操作没有改变,但是高敏感检测、多种类检测、自动化数据收集分析技术的提高,很大 程度地促进了该技术的发展。它已经成为一项先进的生物学技术。当前,科研人员掌握了低噪声杂交探针的制备,能在更广阔的研究领域中运用它。
3.光谱核型分析技术
SKY(spectralkaryotying)光谱染色体自动核型分析是一项显微图像处理技术,SKY通过光谱干涉仪,由高品质CCD获取每一个像素的干涉图像,形成一个三维的数据库并得到每个像素的光程差与强度间的对应曲线,该曲线经傅立叶变换之后得到该像素的光谱,再经由软件分析之后用分类色来显示图像或将光谱数据转换成相应的红绿蓝信号后以常规方式显示。24种全染色体涂染探针先用5种不同的荧光素组合进行不同的标记,然后将探针混合物与中期染色体进行原位杂交,通过荧光显微镜获得荧光图像进行光谱成像。其结果分为显色成像和分色成像两部分。前者可于图像获取后即刻评估所有探针的杂交质量,后者用特定的SKY软件参照每一条染色体特有的光谱信息特征进行分析。在染色体核型排序chromosome karyotyping的应用上,SKY可同时分辨人类的22对染色体及X、Y性染色体或老鼠的21种不同染色体,并以各种颜色呈现出来。SKY技术不同于M- FISH染色体核型技术,后者需由6个或更多的荧光滤镜组来分别取各个颜色的荧光的图像,然后再将所有图像层层堆叠,流程繁琐且信号之间会互相干扰。SKY能做到用一组荧光滤镜,做一次杂交反应,便可得到全部染色体的自动核型定序。传统的利用GRQ或DAPIbanding常常无法就染色体结构上的细微变异,特别是发生在染色体末端的变化做出准确的判断,尤其是当基因体变异发生在G带极为相似的染色体片段时,只有靠频谱分析才能做出快速而准确的诊断。频谱分析的另一个优点是仍然支持传统的G带或DAPI带为基础的染色体核型定序。SKY具有高光透过量和高精确度。SKY能发现经典遗传技术及单独使用FISH技术所不能发现的细微的染色体异常,清楚地鉴别染色体重排,特别是易位、插入及可能产生标记染色体的来源也一目了然。
第二节 测序
测序是对核酸分子的核苷酸排列顺序的测定,也就是测定组成核酸分子的核苷酸A、T、G、C的排列顺序。测序用于测定未知DNA序列,确定重组DNA的方向与结构,对突变进行定位和鉴定、比较研究,是生命科学研究最重要、最常用的技术手段之一。可以说,有基因的地方就有测序。正因为DNA测序的普及化,带动了一批为测序提供商业化技术服务的生物技术企业,形成了一个新兴的测序行业。
测序正处在技术上日新月异的时代,其突出特点是,测序通量(测序数据量)的大幅增长,原始数据中每个碱基的测序成本急剧下跌,并伴随着以巨资购买仪器以引进新技术的需求。以前看似高不可攀的奢侈性研究活动(如个人基因组测序,宏基因组学研究,以及对大量重要物种的测序),在近三十年间年之间,测序技术由一代发展到了三代四代测序技术,随着2001年完成人类基因组框架图,此后基因测序开始进入发展期,以急速的步伐而变得越来越切实可行。
1.一代测序/直接测序
第一代DNA测序技术最初泛指1975年由桑格(Sanger)和考尔森(Coulson)开创的链终止法和1976-1977年由马克西姆(Maxam)和吉尔伯特(Gilbert)发明的化学法(链降解)。后来由于Sanger方法的简便易行,逐渐占据了主导地位,一代测序也可以称为Sanger测序。在1977年,Sanger测定了第一个基因组序列--噬菌体X174,全长5375个碱基。后来的四色荧光桑格测序法(每一种荧光代表四种碱基中的一种)被用在自动毛细管电泳测序系统中,此系统由应用生物系统有限公司(AppliedBiosystemsInc)推上市场,后来该公司被整合入生命技术公司(LifeTechnologies)和贝克曼考尔特公司(BeckmanCoulterinc)。
发表于2001年的第一个人类基因组复合序列就是大体上由细管电泳测序系统来测定完成的,不仅耗资庞大,花费人力无数,而且历时超过十年。尽管发表于2001年的基因组仍然处于有待完善的过程中,但其作为基因组的"参照"序列而被采用,已成为生命科学转化为实际应用的基础,并继续对研究基因型-表现型的关系发挥着重要作用。从迄今为止发表的(和未发表的)文献报道来看,要对人类复杂疾病进深入的有医疗意义的探讨,非常有必要去获得其他类型的"个人"基因组数据,如,特定组织mRNA表达概况、mRNA测序、基因调控区域的个性化分析、表观遗传调控的概况,以高质量和大范围的染色体图谱分析来归类重要的染色体删缺、插入和重排等等。大规模测序中心正完成新一代的测序仪器的转型,联合基因组研究所(theJointGenomeInstituteJGI)已经淘汰了所有的Sanger测序仪。而另一方面,除非小型的第二代测序仪能在清楚读出每个碱基上的成本和测序读长上胜过毛细管电泳测序系统,毛细管测序系统仍将会大量应用于特定区域测序,如定量基因表达、生物标志物鉴定和生物学途径分析等专向性研究。

图1:DNA测序流程图(sanger法)
2.第二代测序技术
第二代技术定义为是同步化三磷酸核苷酸的洗脱方法和同步化的光学检测方法的结合。但这种定义不是很严格,因为有几种算作是第三代测序的实时合成测序的方法,也依赖于光学检测,如太平洋生物科学公司(PacificBiosciences)的单DNA聚合酶测序法就是突出例子。第二代测序技术靠的是连接测序或者合成测序,包括焦磷酸测序和可逆性的链终止法。由罗氏(Roche)、以鲁米那(Illumina)、赫利克斯(Helicos)和生命技术公司(LifeTechnologies)以商业化提供的仪器,以短的连续性的片段序列和测序阅读长度的形式,每周输出数十亿碱基对的DNA序列。
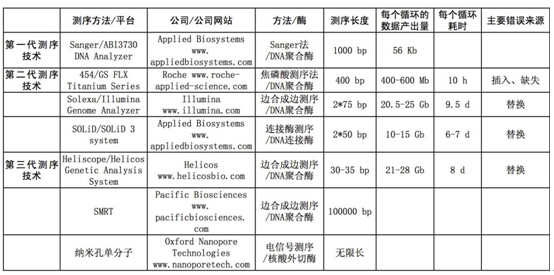
图2:DNA测序技术比较
在新型DNA测序技术领域里,各种技术和资助以从未有过的速度在增长,出现了很多不同的方法,横跨不同代的新技术。每种技术都有自身的优势和局限,因此,从根本上说,要做特定目的的基因分析应用,必须进行合理评估,以选择合适的测序平台。
虽然第二代和第三代平台有很大的通量,但基于Sanger原理的毛细管电泳测序仍是超高精度测序的黄金标准,是迄今为止唯一既能为人类基因组既提供从头测序和又有从头组装技术的技术。下一代测序技术为了获得广泛认同,无论是第二或第三代平台中的哪一种,都必须也同时具备一套第一代毛细管电泳测序平台,并同时将由这两套平台得到的从头测序样品的测序结果和组装结果进行定量比较,方能使人放心而得到广泛的认同。
换言之,无论第二、三代测序平台怎样发展,它们仍然依赖于第一代平台的协助作用。这将为从头测序的真实成本提供坚实的证据,并作为一个出发点,供现在和将来的研究人员去决定如何解决下一波的人类基因组测序计划,或对决定如何开展对一些相似的复杂基因组进行从头测序。目前,既然现有的测序技术局各有其局限性,为了达到对一种复杂的全基因组进行从头测序,可能需要随机采用几种技术,彼此协调配合,以达到测序的高通量,准确性、高读长的相邻重叠片段和大范围的基因绘图。
近几年来,我国DNA测序市场火速发展,以华大基因、生工生物等为龙头的测序类公司均实现100%以上的复合增长;2007-2010年4年间,我国DNA测序的收入每年以200%的速度增长,2009年收入达到3.6亿元,2010年突破7亿元。基因测序领域大致分为设备、测序与应用这三大块,其中有含金量的是测序设备的研发与临床应用的开发。目前,测序仪市场主要被国外公司所占据。Illumina拥有测序市场最大的份额,与罗氏、美国生命科技公司等几大公司垄断了整个测序仪市场,而提供测序服务的企业必须购买测序仪,没有其他的任何替代品,因而提供测序服务的公司对其议价能力较低。以华大基因为例,华大基因于2010年购买了128台Illumina公司的新测序仪HiSeq2000,每台价格69万美元,如此大规模的购买,仍然是依从Illumina的定价。随着测序产业在临床上的应用越来越广泛,期待会有国产测序仪器占据市场份额。
第三节 核酸杂交
核酸分子杂交技术是20世纪70年代发展起来的一种分子生物学技术。它是基于DNA分子碱基互补配对原理,用特异性的核酸探针与待测样品的DNA/RNA形成杂交分子的过程。分子杂交实验依据其形式的不同可以分为液相杂交、固相杂交、原位杂交,而固相杂交又可以分为菌落杂交、点/狭缝杂交、Southern印迹杂交和Northern印迹杂交。各类型杂交的基本原理和步骤是基本相同的,只是选用的杂交原材料、点样方法有所不同。原位杂交是应用核酸探针与组织或细胞中的核酸按碱基配对原则进行特异性结合形成杂交体,然后应用组织化学或免疫组织化学方法在显微镜下进行细胞内定位或基因表达的检测技术。其中在此技术上发展的荧光原位杂交(FISH)技术因其经济、安全、快速、简便、灵敏度高等,在发育生物学、细胞生物学和病理学研究上均得到广泛的应用。近 年来,围绕提高检测的分辨率和灵敏性,不断将免疫染色、量子点和微流控芯片等物理化学技术引入到荧光原 位杂交中,促进了它的快速发展。
荧光原位杂交技术是根据核酸碱基互补配对原理,用半抗原标记 DNA 或者 RNA 探针与经过变性的单链核酸序列互补配对,通过带有荧光基团的抗体去识别半抗原进行检测,或者用荧光基团对探针进行直接标记并与目标序列结合,最后利用荧光显微镜直接观察目标序列在细胞核、染色体或切片组织中的分布情况。FISH 技术发展早期,是应用放射性同位素标记探针来定位目标序列的,直到 1980 年 Bauman 等才将荧光染料直接标记 RNA探针的3’端,并检测到了特异的 DNA;1982年Manuelidis 等采用生物素标记的探针进行了染色体原位杂交。然而由于植物细胞中细胞壁的存在,非放射性生物素标记探针技术直到 1985 年才首次应用于黑麦中 120 bp 重复序列在小麦染色体上的分布研究。因荧光原位杂交技术克服了放射性探针检测周期长且危害人体健康的缺点,被广泛应用于基因定位、染色体识别、物理图谱的构建、进化分析等研究中。FISH 技术常用的半抗原标记物有生物素和地高辛,检测的荧光基团有异硫氰酸荧光素( fluorescein isothiocyanate,FITC) 、花菁染料( cyaninedye) 和罗丹明( rhodamine) 等。
衡量FISH技术两个最重要的参数是分辨率和灵敏度。FISH技术从诞生发展至今已有30多年的历史,期间主要是通过改良靶标序列和探针种类来不断提高其分辨率和灵敏度的。随着 FISH 技术的不断完善与发展,已被广泛 应用于 DNA 序列或基因的定位、核型分析、基因组进化研究、物理图谱的构建、转基因生物的鉴定 等。在FISH 基础上发展起来的多色荧光原位杂交 ( multiplex-FISH,M-FISH) ,可通过多色荧光同时 探测多个目标,如用不同颜色的探针组合来识别人类的24条染色体。继而在M-FISH的基础上又发展了比较基因组原位杂交( comparative genomic hybridization,CGH) 和三维荧光原位杂交( three- dimensional FISH,3D-FISH) 技术。比较基因组原位杂交将供试材料和对照组材料的DNA用不同颜色的荧光基团进行标记,同时在对照组的染色体上进行杂交,根据产生颜色的差异来判断两个基因组相对DNA拷贝数的变化,并将其定位到染色体上。根据CGH-FISH的检测分辨原理,发展了CGH芯片技术和SNP( single nucleotide polymor- phism)芯片技术,然后进行数字化信号采集,使FISH变成了高通量的检测技术。
1.免疫-荧光原位杂交技术
免疫染色( immunostaining) 是生物化学中任何基于抗体来检测样品中特定蛋白质方法的总称。免疫染色最初是指组织切片的免疫组化染色,由Coons首先提出的,目前免疫染色已涵盖了组织学、细胞生物学和分子生物学中所应用的诸多基于抗体的染色技术。免疫染色和荧光原位杂交技术相结合( immuno-FISH) 可用来分析单细胞或者单个染色体水平上的特定序列与其相关联的蛋白质空间结构的关系,拓展了荧光原位杂交技术的应用范围,并且可以作为染色质免疫共沉淀结合的测序技术 ( chromatin immunoprecitation-sequencing,ChIP- seq) 或结合DNA微阵列技术( ChIP-chip) 的一个互补方法。由于染色质 免疫共沉淀结合的测序技术或DNA微阵列技术不能辨别处在细胞周期不同阶段的细胞,这样获得的数据只能代表一些基因不同表达模式的细胞群体或处于不同细胞周期的细胞群体所产生的平均值。免疫染色结合的荧光原位杂交技术可以检测某一时期单细胞水平的某一DNA序列和与之相关联的蛋白质关系及其分布情况,这样有利于消除细胞间的差异性。
Immuno- FISH 还可用来检测特定区域的组蛋白修饰情况,如Zinner等利用三维技术分析了不同染色体组蛋白修饰的差异; Zhang等检测了rDNA重复序列区域组蛋白修饰的分布情况。免疫染色还可以和fiber-FISH相结合,检测被拉伸的染色质区域一些序列和相关蛋白的关系,大大提高了检测的分辨率。Jin等利用免疫染色和fiber-FISH检测了着丝粒序列和着丝粒蛋白的关系。近年来,Immuno-FISH在研究表观遗传学、细胞分裂以及探讨染色质的结构与基因表达的关系等方面发挥了重要的作用。
2.量子点-荧光原位杂交技术
量子点( quantum dot,QD) ,又名半导体纳米晶体,具有独特的光化学和物理性质,已被广泛应用于免疫组化、细胞追踪、活体成像、流式细胞术和荧光原位杂交技术等。与传统有机荧光标记物相比,量子点具有很多优点,如量子点的激发光波长范围宽,而发射光波长范围窄,可以在一个激发光下观察到多个不同的量子点标记物; 通过调节量子点的大小和组成,得到不同发射光谱的量子点,适用于多色标记; 量子点的荧光强度强,不易发生光淬灭等。
荧光原位杂交技术一般采用有机荧光染料来检测杂交信号,但是有机荧光基团容易发生淬灭,而且发射光波长范围宽,做多色杂交并在不同激发光下观察时,很容易串色。将量子点引入到荧光原位杂交体系中,不但可以解决这些问题,而且还大大提高了FISH检测的灵敏度。QD-FISH常通过两种方法来实现: 一是间接标记法,即使用链霉亲和素-量子点偶联物来检测生物素标记的探针,目前市场上已有商业化的试剂盒出售; 二是直接标记法,即使用量子点直接标记探针。尽管QD-FISH技术还不是很成熟,但还是有一些应用研究报道。Xiao和Barker 首先将链霉亲合素偶联的量子点应用到检测人类中期染色体上的荧光原位杂交信号,并且证明量子点比传统的有机荧光染料更耐光漂;Wu等使用合成的巯基乙酸量子点标记的DNA应用于大肠杆菌的荧光原位杂交。随着QD- FISH技术的改进与成熟,量子点作为一种新颖的荧光染料,将会进一步推动分子病理的发展。
3.微流控芯片-荧光原位杂交技术
微流控芯片( microfluidic chip) 技术是把医学、生物、化学等分析过程中的样品制备、反应、分离、检测等步骤集成到一块纳米级的芯片上,称为“芯片实验室”( lab on a chip) 。整个过程可通过计算机操作,具有液体流动可控性、所需样品和试 剂量较少、反应时间短等特点,而且还可以自动化进行大规模的样品分析。而传统的荧光原位杂交中探针的价格十分昂贵,且杂交的整个操作过程繁琐、耗时长, 限制了FISH技术的广泛应用。将微流控芯片与荧光原位杂交相结合( FISH on microchip) ,可以避免这些缺点,并将杂交检测的时间缩短到传统荧光原位杂交所需时间的1 /20,而试剂量仅为原来的1 /10,大大降低了成本,并且可以自动化一次分析多个样本。此 外,在微流控芯片的平台上,免疫染色-荧光原位杂交技术和量子点-荧光原位杂交技术都是可以实现的,并且还可以大大提高检测效率和灵敏度。
第四节 PCR
PCR(Polymerase Chain Reaction)即聚合酶链式反应,是一种在体外快速扩增特定基因或DNA序列的方法,故又称为基因的体外扩增。PCR技术具有特异性强、快速、简便等优点,能在短时间内将所要的目的基因扩增至数万倍,扩增的过程类似于DNA的复制过程,其特异性依赖于靶序列两端的寡核苷酸引物,并且可通过基因的扩增获得目的片段。
PCR技术诞生于20世纪80年代,1983年底12月16日K. Mullis第一次成功实验发明了PCR,1985年《Science》上首次发表关于PCR 的文章。1987 Cetus公司在美国获得PCR基本技术的专利批准。1989《Science》报道了耐热性DNA多聚酶Taq酶的发现,预示着分子时代的到来。Kary Mullis于1993年因PCR的发明获得了诺贝尔化学奖。国内全面开展PCR技术并应用于临川是在90年代中期。1998年实时荧光PCR技术开始在中国较广泛的应用于临床检测;次年西方发达国家尝试将PCR应用于血液筛查。
PCR技术最大的特点是能不断的推出新的形式,其衍生技术如:反转录PCR(RT-PCR)、实时荧光定量PCR、多重PCR及巢式PCR等已广泛应用于生物医疗领域,如:疾病基因检测、遗传病的产前诊断、致病病原体的检测、肿瘤个体化治疗的基因检测、DNA指纹、个体识别、亲子关系鉴别、法医物证以及动、植物检疫等等。
PCR技术根据用途不同可分为普通PCR类和定量PCR类。普通PCR适用于定性分析,富集克隆目的基因片段,其产物一般在100bp到数kb不等,是很多衍生技术的基础。定量PCR是在普通PCR的基础上加入荧光染料或用有荧光标记的探针实时监控DNA的含量变化以对模版中的DNA进行定量分析(绝对定量与相对定量)。荧光定量PCR是目前在临床中应用最为广泛的PCR技术,也是目前对临床诊断影响最深远的分子诊断技术,主要包括:ARMS法荧光定量PCR技术、染料法荧光定量PCR技术、Taqman探针法荧光定量PCR技术及数字PCR技术等。
1.染料法荧光定量PCR技术
荧光染料能结合在DNA双链结构的小沟中,而游离的荧光染料不发出荧光,因此扩增开始时检测不到荧光信号。随着扩增的进行,荧光染料与逐渐增多的dsDNA结合,荧光强度逐渐增强,直到达到阈值,被荧光探测系统检测到。通过对已知拷贝数,不同稀释倍数的阳性模板做荧光定量PCR,即可做出标准曲线。未知样品通过与标准曲线比较,即可得出定性和定量的结果。在反应体系中,其信号强度即代表了双链 DNA 分子的数量。研究中常用染料有Pico Green和SYBR Green。Pico Green是一种新型的染料,与SYBR Green相比,其灵敏度较高,可以检测出至少25 pg·mL-1 的dsDNA 分子,且具有线性范围广,RNA、ssDNA及其他物质的影响小的优点。荧光染料法其优势在于检测方法简便,检测成本低。不足之处是由于染料与DNA双链分子的结合是非特异性的,它可以和反应体系中的所有DNA分子结合,因此易受到非特异性扩增和引物二聚体的影响,使定量结果不可靠。所以,其特异性不如探针法。针对这一问题可以借助融解曲线(HRM)分析法来区分非特异性产物和引物二聚体而排除假阳性。此外,也可以通过设计特异性引物、优化PCR的反应条件,减少或去除非特异性产物和引物二聚体的产生以提高特异性进行定性诊断。
2.探针法荧光定量PCR技术
TaqMan探针是应用最广的水解探针,其原理主要是在PCR反应体系加入一个特异的荧光标记探针,根据FRET原理,当探针保持完整时,3'端淬灭基团抵消了5'端发射基团的荧光发射,这时检测不到荧光信号。在PCR的退火期,探针与模板发生特异性杂交,当延伸期引物在Taq 酶作用下沿DNA模板延伸到达探针处,由于所用Taq酶具有 5'→3' 外切活性,发生置换反应,使 5'端标记荧光发射基团FAM(6-羧基荧光素)与3'端标记荧光淬灭基团TAMRA(6-羧基四甲基若丹明)分离,荧光信号得到释放,这时荧光探测系统就能检测到光密度的增加。模板每复制1次,就有1个探针被切断,伴随着1个荧光信号被释放。由于理论上被释放的荧光基团数和PCR产物数是一对一的关系,因此根据PCR反应液中的荧光强度即可计算出初始模板的数量。
分子信标,由Tyagi 和Krammer 建立。该种探针是一段茎环发夹结构的单链 DNA 分子,环部与靶DNA序列互补,为约15~35 bp,茎部由GC含量较高的与靶DNA无序列同源性的互补序列构成,约8 bp,探针的5'端与3'端分别标记荧光报告基团和荧光淬灭基团。当分子信标处于自由状态时,发夹结构的两个末端靠近使荧光报告基团与淬灭荧光基团靠近,荧光信号被淬灭。当有靶序列存在时,分子信标与靶序列结合,使分子信标的茎秆区被拉开,3'端与5'端分离,此时荧光报告基团不能被淬灭,荧光检测仪器可检测到荧光。随着每次扩增产物的积累,荧光强度增加,可反映出每次扩增末扩增产物积累的量。分子信标法的特点是探针可循环利用,理论上分子信标能区分仅单个核苷酸差异的DNA,特异性比常规等长的寡核苷酸探针更明显。但探针标记较复杂,并且要求游离在溶液中时探针能无选择性折叠,否则会造成部分荧光本底信号;同样当茎结构的热力学温度过高时,则会影响探针与靶序列杂交。
突变扩增阻滞系统(amplification refractory mutation system,ARMS)。于1989年初次建立,是对多重PCR技术应用的借鉴和发展。也称等位基因特异性扩增法(Allele-specific amplification)ASA,或等位基因特性PCR(allele-specific PCR,ASPCR)等,为在同一系统中同时检测两种或多种等位基因突变位点奠定了基础。主要的ARMS法如:Scorpion(蝎型)引物/探针法,是由1条发夹结构的探针和1条引物构成,探针的5'端和3'端分别标有报告荧光和淬灭荧光,3'端通过1个非扩增的单体(防止探针退火后的延伸) 与引物的5'端相连。在探针上由于荧光报告基团与淬灭基团相互靠近,不发荧光。变性阶段,探针的发夹结构会解开,在退火时则与模板相结合,形成线性分子,报告基团同淬灭基团分离而发射荧光。因此可检测到报告荧光发出的荧光信号;ADxARMS法,由1条单环引物和一条双环形探针构成,根据突变序列设计特异性的ARMS引物,该ARMS引物在第一阶段扩增中采用较高的退火温度,ARMS引物扩增的特异性较好,只能够扩增与之匹配的突变序列,但扩增效率较低。本阶段扩增的目的是将模板中较少的突变序列进行放大。起到突变富集的作用。同时该ARMS 引物的5’端带上为第二阶段扩增准备的特殊序列。第二阶段中采用较低的退火温度,同时采用通用引物进行扩增,通用引物是针对第一阶段扩增过程中引物5’端的特殊序列。这样较低的退火温度,保证了扩增的高效率。扩增得到的模板用新型探针进行检测。此方法大大提高了检测的灵敏度,可准确检测出含量低至1%的突变DNA。
3.数字PCR技术
数字PCR(digitalPCR,dPCR)是近年来引起重视并迅速发展起来的一种突破性的定量分析技术。1992年Sykes等检测复杂背景下低丰度的IgH重链突变基因时,利用样品的有限稀释,让每个孔中只获得单个模板分子,通过计算PCR扩增后的信号,以期准确地确定起始分子的数量,虽然没有明确提出“数字PCR”的概念,但是已经建立了数字PCR基本的实验流程,并且确定了数字PCR检测中一个极其重要的原则——以“终点信号的有或无”作为定量方法。这是数字PCR的雏形。1999年Vogelstein等在检测粪便中进行癌变组织脱离细胞的BRAF突变时,因受到体细胞基因的干扰,而碰到检测灵敏度和检测分辨率的瓶颈,而采用了在384孔板中对每个反应孔的样品量进行极限稀释并增加反应孔数进行检测的方式, 从而提出了数字式PCR的概念,同时也提出如果采用更多孔板其检测灵敏度会更高,从而指出了数字PCR系统的发展方向。
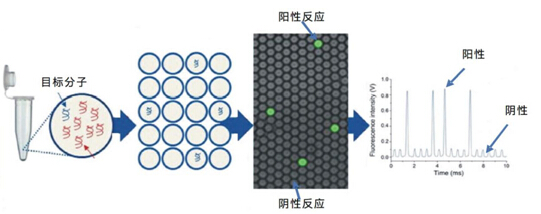
图3:数字PCR原理示意图
数字PCR一般包括两部分内容,即PCR扩增和荧光信号分析。在PCR扩增阶段,数字PCR先将样品稀释到单分子水平,再平均分配到几十至几万个单元中进行反应。与qPCR对每个循环进行实时荧光测定的方法不同,数字PCR是在扩增结束后对每个反应单元的荧光信号进行采集,有荧光信号记为1,无荧光信号记为0,有荧光信号的反应单元中至少包含一个拷贝的。理论上,在样品中目标DNA浓度极低的情况下,有荧光信号的反应单元数目等于目标DNA分 子的拷贝数。但是,通常每反应单元中可能包含两个或两个以上的目标分子,就需要使用泊松概率分布函数(Poisson distribution)进行计算,根据反应单元总数、有荧光信号的单元数以及样品的稀释系数,就可以得到样本的最初拷贝数(浓度)。
数字PCR的关键是稀释模板,通过将一个样本分成几十到几万份,分配到不同的反应单元,每个单元包含0个或一个(至多数个拷贝) 的目标分子,在每个反应单元中分别对目标分子进行PCR扩增,扩增结束后对每个反应单元的荧光信号进行统计学分析。数字PCR的灵敏度,除了与检测器的灵敏度和PCR扩增效率等因素有关外,很大程度上取决于反应单元的数目。反应单元的数目越多,数字PCR的灵敏度越高,准确度也越高。根据反应单元形成的不同方式, 主要有微反应室/ 孔板、微流控芯片和微滴等三类数字 PCR系统。(1)微反应室/孔板数字PCR:早期的数字PCR技术采用96/384孔板作为反应单元。但是数字PCR技术的灵敏度取决于反应单元的总数,反应单元数越多越有利于提高灵敏度和准确度,普通的96/384孔板无法满足检测的需要。因此,出现了成倍提高反应单元数目的做法,反应体积从微升级降至纳升级。但是随着反应单元数目的增多、反应体积的减少,人工操作无法实现快速精准取样,就需要借助高通量自动上样设备, 大幅提高了仪器成本和操作复杂性;(2)微流控芯片数字PCR:微流控芯片技术的使用使数字PCR能够快速并准确地将样品流体分成若干个独立的单元,进行多步平行反应,成本低、体积小和高通量,是理想的数字PCR平台。目前Fluidigm公司的Bio-MarkTM基因分析系统,Life Technologies公司的QuantStudioTM 3D数字PCR系统均均为采用微流控芯片技术的数字PCR系统;(3)微滴数字PCR:源于乳液PCR(emulsion PCR)技术,利用微滴发生器可以一次生成数万乃至数百万个纳升甚至皮升级别的单个油包水微滴,作为数字PCR的样品分散载体。PCR反应结束后检测每个微滴的荧光信号。通过油水两相间隔得到的以液滴为单位的PCR反应体系,更容易实现小体积和高通量,而且系统简单,成本低,因此成为理想的数字PCR技术平台。目前Rain Dance公司的Rain DropTM数字PCR 系统,Bio-Rad公司的QX100系统、QX200系统均为采用液滴技术的数字PCR系统。
虽然数字PCR概念提出至今已经有二十多年,但其应用仍处于起步阶段,但是由于其独特的技术优势和应用前景,近几年来其产业化发展相当迅速,应用也越来越得到重视,已经成功的应用于肿瘤组织内的 EGFR检测以及EGFR突变频率的分析。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设